Tiêu chuẩn Việt Nam TCVN 5164:2008 (EN 14122:2003) về thực phẩm - xác định vitamin B1 bằng sắc ký lỏng hiệu năng cao (HPLC) đã được thay thế bởi Tiêu chuẩn quốc gia TCVN 5164:2018 (EN 14122:2014) về Thực phẩm - Xác định vitamin B1 bằng sắc ký lỏng hiệu năng cao .
Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 5164:2008 (EN 14122:2003) về thực phẩm - xác định vitamin B1 bằng sắc ký lỏng hiệu năng cao (HPLC)
TIÊU CHUẨN QUỐC GIA
TCVN 5164:2008
EN 14122:2003
THỰC PHẨM – XÁC ĐỊNH VITAMIN B1 BẰNG SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC)
Foodstuffs – Determination of vitamin B1 by high performance liquid chromatography (HPLC)
Lời nói đầu
TCVN 5164:2008 thay thế TCVN 5164:1990;
TCVN 5164:2008 hoàn toàn tương đương với EN 14122:2003;
TCVN 5164:2008 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM – XÁC ĐỊNH VITAMIN B1 BẰNG SẮC KÝ LỎNG HIỆU NĂNG CAO (HPLC)
Foodstuffs – Determination of vitamin B1 by high performance liquid chromatography (HPLC)
CẢNH BÁO – Khi áp dụng tiêu chuẩn này có thể cần phải sử dụng các vật liệu, thiết bị và các thao tác nguy hiểm. Tiêu chuẩn này không đề cập đến các vấn đề an toàn khi sử dụng chúng. Người sử dụng tiêu chuẩn này phải tự thiết lập các thao tác an toàn thích hợp và xác định khả năng áp dụng các giới hạn qui định trước khi sử dụng tiêu chuẩn.
1. Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp xác định vitamin B1 trong thực phẩm bằng sắc ký lỏng hiệu năng cao (HPLC). Hàm lượng vitamin B1 là khối lượng thiamin tổng số bao gồm các dẫn xuất đã tách phospho.
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi.
TCVN 4851:1989 (ISO 3696:1987), Nước dùng để phân tích trong phòng thí nghiệm. Yêu cầu kỹ thuật và phương pháp thử.
3. Nguyên tắc
Thiamin được chiết ra khỏi thực phẩm sau khi thủy phân bằng axit rồi tách phospho sử dụng cách xử lý bằng enzym và định lượng bằng HPLC có dẫn xuất sau cột hoặc trước cột với thiocrom [1] đến [6].
4. Thuốc thử
4.1. Yêu cầu chung
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và chỉ sử dụng nước cất hoặc nước ít nhất là loại 1 của TCVN 4851:1989 (ISO 3696:1987) hoặc nước cất hai lần, trừ khi có qui định khác.
4.2. Hóa chất và các dung dịch
4.2.1. Metanol, loại dùng cho HPLC, w(CH3OH) ≥ 99,8 % (khối lượng).
4.2.2. Dung dịch axit axetic, c(CH3COOH) = 0,02 mol/l.
4.2.3. Isobutanol, w(C4H10O) ≥ 98%.
4.2.4. Natri dihydro phosphat, w(NaH2PO4) ≥ 99,8%.
4.2.5. Axit clohydric, w(HCl) = 36%.
4.2.6. Axit clohydric, c(HCl) = 0,1 mol/l.
4.2.7. Axit sulfuric, c(H2SO4) = 0,05 mol/l.
4.2.8. Natri hydroxit, w(NaOH) ≥ 99%.
4.2.9. Dung dịch natri hydroxit, nồng độ khối lượng ρ(NaOH) = 150 g/l.
4.2.10. Dung dịch natri hydroxit, ρ(NaOH) = 200 g/l.
4.2.11. Kali hexaxyanoferat III,
w![]() ≥ 99%.
≥ 99%.
4.2.12. Dung dịch kali
hexaxyanoferat III, ![]() = 10 g/l.
= 10 g/l.
4.2.13. Dung dịch kali
hexaxyanoferat III kiềm (dẫn xuất trước cột), ![]() = 0,4
g/l.
= 0,4
g/l.
Pha loãng 2,0 ml dung dịch hexaxyanoferat (4.2.12) bằng dung dịch natri hydroxit (4.2.9) đến 50 ml. Chuẩn bị dung dịch này trong ngày phân tích.
4.2.14. Dung dịch kali
hexaxyanoferat III kiềm (dẫn xuất sau cột), ![]() =
0,5g/l.
=
0,5g/l.
Pha loãng 2,5 ml dung dịch hexaxyanoferat (4.2.12) bằng dung dịch natri hydroxit (4.2.10) đến 50 ml.
4.2.15. Enzym tách phospho, có khả năng thủy phân thiamin liên kết từ thực phẩm.
CHÚ THÍCH: Taka-Diataza1) đã được sử dụng để xác định các dữ liệu về độ chụm.
4.2.16. Dung dịch natri axetat, c(CH3COONa.3H2O) = 2,5 mol/l.
4.2.17. Dung dịch natri axetat, c(CH3COONa.3H2O) = 0,5 mol/l.
4.2.18. Pha động HPLC
Các ví dụ về các hỗn hợp thích hợp với các phần thể tích ví dụ như từ 10% đến 50% metanol (4.2.1) trong nước hoặc sử dụng phosphat hoặc dung dịch đệm axetat được nêu trong Phụ lục C. Khả năng sử dụng các tác nhân kết cặp ion cũng được nêu trong Phụ lục C.
4.2.19. Dung dịch đệm phosphat (pH = 3,5), c(KH2PO4) = 9,0 mmol/l.
4.2.20. Tetraetylamoniclorua, w(C8H20NCl) ≥ 98%.
4.2.21. Natri heptansulfonat, w(C7H15NaO3S) ≥ 98%.
4.2.22. Dung dịch đệm axatat (pH = 4,0), c(CH3COOH) = 50 mmol/l.
4.3. Chất chuẩn
4.3.1. Yêu cầu chung
Thiamin clorua hydroclorua có thể lấy được từ nhiều nhà cung cấp. Độ tinh khiết của các chất chuẩn thiamin có thể khác nhau, do đó có thể cần phải xác định nồng độ của dung dịch hiệu chuẩn bằng đo phổ UV (xem 4.4.4).
4.3.2. Thiamin clorua hydroclorua, w(C12H17ClN4OS.HCl) ≥ 99%.
4.3.3. Thiamin monophosphat clorua, w(C12H17ClN4O4PS) ≥ 98%.
4.3.4. Thiamin pyrophosphat clorua (cocarboxylaza), w(C12H19ClN4O7P2S) ≥ 98%.
4.4. Dung dịch gốc
4.4.1. Thiamin clorua
hydroclorua, ρ(C12H17ClN4OS.HCl) ![]() 0,1 mg/ml
0,1 mg/ml
Hòa tan một lượng chính xác của chất chuẩn thiamin clorua hydroclorua (4.3.2) trong một thể tích xác định của dung môi thích hợp, ví dụ như 10 mg chất chuẩn vitamin B1 trong 100 ml axit clohydric (4.2.6). Dung dịch này có thể ổn định được bốn tuần ở nhiệt độ + 4oC.
4.4.2. Thiamin monophosphat,
ρ(C12H17ClN4O4PS) ![]() 0,1 mg/ml
0,1 mg/ml
Hòa tan một lượng chính xác của chất chuẩn monophosphat (4.3.3) trong một thể tích xác định của dung môi thích hợp, ví dụ như 10 mg chất chuẩn monophosphat trong 100 ml axit clohydric (4.2.6). Dung dịch này có thể ổn định được bốn tuần ở nhiệt độ - 20 oC.
4.4.3. Thiamin pyrophosphat,
ρ(C12H19ClN4O7P2S) ![]() 0,1 mg/ml
0,1 mg/ml
Hòa tan một lượng chính xác của chất chuẩn pyrophosphat (4.3.4) trong một thể tích xác định của dung môi thích hợp, ví dụ như 10 mg chất chuẩn pyrophosphat trong 100 ml axit clohydric (4.2.6).
4.4.4. Kiểm tra nồng độ
Pha loãng 10 ml dung dịch gốc thiamin clorua hydroclorua (4.4.1) bằng dung dịch axit clohydric (4.2.6) trong bình định mức 100 ml đến vạch. Đo độ hấp thụ của dung dịch này ở bước sóng 247 nm trong cuvet 1 cm dựa vào dung dịch axit clohydric (4.2.6) trong cuvet đối chứng sử dụng máy đo phổ UV (5.2). Tính nồng độ khối lượng, ρ, bằng microgram trên mililit dung dịch gốc, sử dụng công thức (1):
![]() (1)
(1)
Trong đó
![]() là
giá trị hấp thụ của dung dịch ở bước sóng cực đại khoảng 247 nm;
là
giá trị hấp thụ của dung dịch ở bước sóng cực đại khoảng 247 nm;
421 là hệ số hấp thụ ![]() của thiamin clorua hydroclorua trong
axit clohydric 0,1 mol/l (xem [7]);
của thiamin clorua hydroclorua trong
axit clohydric 0,1 mol/l (xem [7]);
10 là hệ số pha loãng.
4.5. Dung dịch chuẩn
4.5.1. Thiamin clorua
hydroclorua, ρ(C12H17ClN4OS.HCl) ![]() 0,1 μg/ml đến 10 μg/ml
0,1 μg/ml đến 10 μg/ml
Dùng pipet lấy từ 1 ml đến 10 ml dung dịch gốc thiamin clorua hydroclorua (4.4.1) cho vào bình định mức 100 ml và pha loãng đến vạch bằng dung môi thích hợp, ví dụ như axit clohydric (4.2.6). Dung dịch này có thể ổn định được 1 tháng ở nhiệt độ 4 oC, nơi tối.
4.5.2. Thiamin monophosphat,
ρ(C12H17ClN4O4PS) ![]() 1 μg/ml đến 10 μg/ml
1 μg/ml đến 10 μg/ml
Dùng pipet lấy từ 1 ml đến 10 ml dung dịch gốc monophosphat (4.4.2) cho vào bình định mức 100 ml và pha loãng đến vạch bằng dung môi thích hợp, ví dụ như axit clohydric (4.2.6). Dung dịch này có thể ổn định được 1 tháng ở nhiệt độ 4 oC ở nơi tối.
4.5.3. Thiamin pyrophosphat,
ρ(C12H19ClN4O7P2S) ![]() 1 μg/ml đến 10 μg/ml
1 μg/ml đến 10 μg/ml
Dùng pipet lấy từ 1 ml đến 10 ml dung dịch gốc pyrophosphat (4.4.3) cho vào bình định mức 100 ml và pha loãng đến vạch bằng dung môi thích hợp, ví dụ như axit clohydric (4.2.6). Dung dịch này có thể ổn định được 1 tháng ở nhiệt độ 4 oC ở nơi tối.
5. Thiết bị, dụng cụ
5.1. Yêu cầu chung
Sử dụng các thiết bị phòng thử nghiệm thông thường và cụ thể như sau:
5.2. Máy đo phổ UV
Có thể đo các độ hấp thụ ở các bước sóng xác định.
5.3. Thiết bị hấp áp lực hoặc làm nóng
Dùng thiết bị áp lực cho mục đích tách chiết, ví dụ như kiểu nồi hấp áp lực, có bộ phận ghi nhiệt độ và áp suất, bộ phận đốt nóng bằng điện hoặc nồi cách thủy.
5.4. Hệ thống sắc ký lỏng hiệu năng cao
Gồm có bơm, bộ phận bơm mẫu, detector huỳnh quang có các bước sóng phát xạ và kích thích đã cài đặt, ví dụ như 420 nm và 366 nm, tương ứng (xem Phụ lục C) và hệ thống đánh giá như bộ tích phân.
5.5. Cột HPLC
5.5.1. Yêu cầu chung
Có thể sử dụng các cột hoặc cỡ hạt có kích cỡ khác với qui định trong tiêu chuẩn này. Các thông số riêng cần phù hợp với vật liệu sử dụng để đảm bảo các kết quả tương đương. Chuẩn mực thực hiện đối với các cột phân tích thích hợp là độ phân giải đường nền của các chất phân tích có liên quan2).
5.5.2. Ôxy hóa trước cột
Cột phân tích, ví dụ như Lichropher® 60 RP Select B2), cỡ hạt 5 μm, đường kính từ 4,0 mm đến 4,6 mm, dài từ 100 mm đến 250 mm.
5.5.3. Ôxy hóa sau cột
Cột phân tích, ví dụ như Supeco® LC-18-DB 2), cỡ hạt 5 μm, đường kính từ 4,0 mm đến 4,6 mm, dài từ 100 mm đến 250 mm.
5.6. Thiết bị lọc
Lọc pha động cũng như lọc dung dịch mẫu thử qua bộ lọc màng, ví dụ như 0,45 μm trước khi sử dụng hoặc bơm sẽ kéo dài tuổi thọ của cột.
5.7. Bơm phản ứng sau cột và ống dẫn xuất
Hệ thống phân phối thuốc thử thích hợp là ống nối kiểu chữ T và ống dẫn xuất (ví dụ như 10 m x 0,33 mm).
6. Cách tiến hành
6.1. Chuẩn bị dung dịch mẫu
Đồng hóa mẫu thử. Nghiền thô nguyên liệu trong máy nghiền thích hợp và trộn lại. Cần thực hiện các biện pháp như làm nguội sơ bộ để tránh tiếp xúc với nhiệt độ cao trong thời gian dài.
6.2. Chuẩn bị dung dịch mẫu thử
6.2.1. Tách chiết
Cân một lượng mẫu thử thích hợp từ 2 g đến 10 g, chính xác đến mg, cho vào bình nón. Thêm một thể tích xác định từ 60 ml đến 200 ml dung dịch axit clohydric (4.2.6) hoặc axit sulfuric (4.2.7). pH của dung dịch này không được lớn hơn 3,0. Đậy nắp bình bằng mặt kính đồng hồ và hấp áp lực ở 121 oC trong 30 min hoặc làm nóng ở 100 oC trong 60 min.
CHÚ THÍCH: Dữ liệu từ nghiên cứu BCR cho thấy rằng có thể áp dụng một dải rộng các điều kiện đối với việc thủy phân bằng axit (nhiệt độ từ 95oC đến 130 oC, thời gian từ 15 min đến 60 min). Nhiệt độ cao hơn thì thời gian ngắn hơn.
6.2.2. Xử lý bằng enzym
Sau khi làm nguội đến nhiệt độ phòng, chỉnh chính xác pH tối ưu cho enzym bằng dung dịch natri axetat (4.2.16) hoặc (4.2.17) và thêm một lượng thích hợp enzym tách phospho (4.2.15) vào mẫu. Ủ hỗn hợp trong một khoảng thời gian và nhiệt độ tối ưu đối với enzym sử dụng. Sau khi làm nguội đến nhiệt độ phòng, dùng nước cất hoặc dung môi thích hợp để chuyển dung dịch vào bình định mức tránh ánh sáng và pha loãng đến thể tích xác định (Ve).
Đối với mỗi enzyme sử dụng, cần kiểm tra pH tối ưu, nhiệt độ ủ và thời gian ủ.
Để đảm bảo khử phospho tối ưu, bước xử lý bằng enzyme cần được kiểm tra bằng các mẫu đã xử lý với thiamin monophosphat clorua (4.3.3) hoặc thiamin pyrophosphat clorua (4.3.4) và vật liệu tương tự trong ống mẫu làm mẫu thử. Vật liệu này phải là chất chuẩn đã được xác nhận.
Nếu sử dụng Taka-Diastaza để khử phosphat thì lượng thiamin có khả năng đưa vào bằng enzym cần được tính đến trong tính toán kết quả.
CHÚ THÍCH 1: Để xác định dữ liệu về độ chụm trong tiêu chuẩn này, Taka-Diastaza1) đã được sử dụng để khử phospho dưới các điều kiện sau đây. Dịch chiết đã được điều chỉnh đến pH = 4,0 với natri axetat (4.2.16) hoặc (4.2.17) và đã bổ sung 100 mg Taka-Diastaza trên gam mẫu. Hỗn hợp này được ủ ở 37 oC đến 46 oC trong 16 h đến 24 h.
CHÚ THÍCH 2: Việc khử phospho phụ thuộc vào chất nền của mẫu và enzyme đã sử dụng. Việc khử phospho có thể thực hiện trong một thời gian ngắn, xem [8].
6.2.3. Oxy hóa thiamin về thiocrom
6.2.3.1. Oxy hóa trước cột
Dùng pipet lấy 1 ml mẫu thử đã xử lý bằng enzym (6.2.2), dung dịch chuẩn (4.5.1) hoặc dung dịch trắng cho vào bình cầu hoặc lọ thích hợp, thêm 1 ml dung dịch hexaxyanoferat kiềm (4.2.13). Lắc dung dịch mẫu thử trong thời gian qui định (ví dụ: 10s), để yên trong khoảng thời gian qui định (ví dụ: 1 min) và tiếm lên hệ thống HPLC pha đảo (xem Bảng C.1).
Cách khác, dung dịch đã oxy hóa có thể được chiết vào 1,5 ml isobutanol (4.2.3) và có thể bơm dịch chiết (ví dụ bằng H3PO4). Để loại bỏ các hợp chất gây nhiễu và bảo vệ cột HPLC thì nên trung hòa hoặc tiến hành làm sạch bằng chiết pha rắn (xem [5]).
CHÚ THÍCH: Việc chuyển hóa thiamin thành thiocrom có thể bị ức chế bởi các chất có mặt (ví dụ như polyphenol) trong một số loại thực phẩm. Hiện tượng này thường gặp trong các thực phẩm chứa cacao, cũng có thể thấy trong một số thực phẩm khác. Nếu nghi ngờ có hiện tượng này thì nên kiểm tra độ thu hồi của phương pháp bằng cách xử lý dịch chiết mẫu bằng một thể tích thích hợp của dung dịch chuẩn thiamin trước phản ứng oxy hóa. Nếu độ thu hồi quá thấp thì nên tiến hành làm sạch dịch chiết mẫu sử dụng resin trao đổi ion hoặc sử dụng HPLC có oxy hóa sau cột.
6.2.3.2. Nhận dạng bằng oxy hóa trước cột
Bơm các thể tích thích hợp giống nhau của các dung dịch hiệu chuẩn cũng như các dung dịch mẫu vào hệ thống HPLC. Nhận dạng thiocrom bằng so sánh thời gian lưu của các pic riêng lẻ trong sắc ký đồ thu được từ dung dịch mẫu thử và dung dịch chuẩn. Việc thêm các chất chuẩn vào dung dịch mẫu thử cũng có thể nhận dạng được pic.
Việc tách và định lượng được chứng minh là thỏa mãn nếu các điều kiện thực nghiệm sau đây đã được thực hiện (xem thêm Hình A.1 và Phụ lục C về các điều kiện HPLC thay thế).
Pha tĩnh: Lichrospher® RP Select B, 5 μm, 250 mm x 4,0 mm
Pha động: Metanol (4.2.1): đệm axetat (4.2.22)
Tốc độ dòng: 0,7 ml/min
Thể tích bơm: 20 μl
Phát hiện: Huỳnh quang: bước sóng kích thích là 366 nm; bước sóng phát xạ là 435 nm.
6.2.3.3. Ôxy hóa sau cột
Oxy hóa thiamin về thiocrom sử dụng phản ứng sau cột với dung dịch hexaxyanoferat (4.2.14). Thêm liên tục (ví dụ: 0,3 ml/min) thuốc thử dẫn xuất qua ống nối kiểu chữ T cho vào dịch rửa giải HPLC để tạo thành thiocrom.
CHÚ THÍCH: Việc oxy hóa sau cột bị ảnh hưởng ví dụ như nồng độ natri hydroxit. Các nồng độ cao hơn trong dung dịch dẫn xuất có thể được bù bởi tốc độ bơm thấp hơn và ngược lại.
6.2.3.4. Nhận dạng bằng oxy hóa sau cột
Bơm các thể tích thích hợp giống nhau của các dung dịch hiệu chuẩn cũng như các dung dịch mẫu vào hệ thống HPLC. Nhận dạng thiamin bằng so sánh thời gian lưu của các pic riêng lẻ trong sắc ký đồ thu được từ dung dịch mẫu thử và dung dịch thử chuẩn. Việc thêm các chất chuẩn vào dung dịch mẫu thử cũng có thể nhận dạng được pic.
Việc tách và định lượng được chứng minh là thỏa mãn nếu các điều kiện thực nghiệm sau đây đã được thực hiện (xem thêm Hình A.2 và Phụ lục C về các điều kiện HPLC thay thế).
Pha tĩnh: Supelco® LC-18-DB, 5 μm, 250 mm x 4,6 mm
Pha động: Metanol (4.2.1): đệm phosphat (4.2.19), chứa 1 g/l tetraetylamoni-clorua (4.2.20) và 5 mmol/l natri heptanesulfonat (4.2.21), (35:65)
Tốc độ dòng: 1,0 ml/min
Thể tích bơm: 20 μl
Thuốc thử sau cột: dung dịch kali hexaxyanoferat III kiềm (4.2.14)
Tốc độ dòng thuốc thử: 0,3 ml/min
Phát hiện: Huỳnh quang: bước sóng kích thích là 368 mm; bước sóng phát xạ là 440 nm.
CHÚ THÍCH: Việc phân tích một số mẫu, ví dụ như thịt lợn nguyên liệu có thể cho pic bổ sung của 1-hydroxy-thiamin hoặc 2 (1-hydroxyetyl) thiamin trong sắc đồ xem [10] và [11].
6.3. Phép xác định
Tiến hành xác định bằng ngoại chuẩn, xác định diện tích pic hoặc chiều cao pic của mẫu và so sánh các kết quả với các giá trị tương ứng của chất chuẩn có các chiều cao pic hoặc diện tích pic gần giống nhất, hoặc sử dụng đường chuẩn. Kiểm tra độ tuyến tính của việc hiệu chuẩn.
7. Tính toán
Tính theo đường chuẩn hoặc sử dụng chương trình thích hợp của bộ tích phân hoặc sử dụng quy trình đã đơn giản hóa sau đây. Tính khối lượng vitamin B1, w, biểu thị theo thiamin clorua hydroclorua, bằng mg/100 g mẫu, theo công thức sau đây:
![]()
Trong đó:
Ats là diện tích pic hoặc chiều cao pic của thiocrom thu được với dung dịch mẫu thử, tính bằng đơn vị chiều cao hoặc diện tích;
Ast là diện tích pic hoặc chiều cao pic của thiocrom thu được với dung dịch thử chuẩn, tính bằng đơn vị chiều cao hoặc diện tích;
Ve là thể tích dung dịch mẫu thử (6.2.2), tính bằng mililít.
ρ là nồng độ khối của thiamin clorua hydroclorua trong dung dịch thử chuẩn (4.5.1), tính bằng microgram trên mililít;
ms là khối lượng của mẫu, tính bằng gam;
100 là hệ số để tính hàm lượng trên 100 g;
1000 là hệ số chuyển đổi μg/100 g thành mg/100 g.
Báo cáo kết quả vitamin B1 bằng mg/100 g được biểu thị theo thiamin clorua hydroclorua. Nếu cần phải biểu thị kết quả theo thiamin (C12H17ClN4OS) thì nhân kết quả với hệ số 0,892.
8. Độ chụm
8.1. Yêu cầu chung
Dữ liệu về độ chụm của các phương pháp HPLC khác nhau để xác định thiamin được thiết lập năm 1996 bởi nghiên cứu so sánh quốc tế do Chương trình của Ủy ban Châu Âu về Thử nghiệm và Đo chuẩn thực hiện trên mẫu bột mì (CRM 121), bột sữa (CRM 421), rau hỗn hợp (CRM 485) và gan lợn đông khô (CRM 487). Nghiên cứu này đã cung cấp thông tin về thống kê như trong Phụ lục B.
8.2. Độ lặp lại
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ, thu được khi tiến hành trên vật liệu thử giống hệt nhau, do một người thực hiện sử dụng cùng thiết bị, trong một khoảng thời gian ngắn, không quá 5% các trường hợp vượt quá giới hạn lặp lại r.
Các giá trị đối với thiamin clorua hydroclorua là:
Bột mì: ![]() = 0,452 mg/100 g r
= 0,043 mg/100 g
= 0,452 mg/100 g r
= 0,043 mg/100 g
Bột sữa: ![]() = 0,645 mg/100 g r
= 0,071 mg/100 g
= 0,645 mg/100 g r
= 0,071 mg/100 g
Rau hỗn hợp: ![]() = 0,295 mg/100 g r
= 0,039 mg/100 g
= 0,295 mg/100 g r
= 0,039 mg/100 g
Gan lợn: ![]() = 0,807 mg/100 g r
= 0,088 mg/100 g
= 0,807 mg/100 g r
= 0,088 mg/100 g
8.3. Độ tái lập
Chênh lệch tuyệt đối giữa hai kết quả thử riêng rẽ, thu được bởi hai phòng thử nghiệm khi tiến hành trên vật liệu thử giống hệt nhau, không quá 5% các trường hợp vượt quá giới hạn tái lập R. Các giá trị đối với thiamin clorua hydroclorua là:
Bột mì: ![]() = 0,452 mg/100 g R
= 0,190 mg/100 g
= 0,452 mg/100 g R
= 0,190 mg/100 g
Bột sữa: ![]() = 0,645 mg/100 g R
= 0,243 mg/100 g
= 0,645 mg/100 g R
= 0,243 mg/100 g
Rau hỗn hợp: ![]() = 0,295 mg/100 g R
= 0,178 mg/100 g
= 0,295 mg/100 g R
= 0,178 mg/100 g
Gan lợn: ![]() = 0,807 mg/100 g R
= 0,623 mg/100 g
= 0,807 mg/100 g R
= 0,623 mg/100 g
9. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ ít nhất các thông tin sau đây:
a) mọi thông tin cần thiết để nhận biết đầy đủ về mẫu;
b) phương pháp thử đã dùng hoặc viện dẫn tiêu chuẩn này;
c) ngày và phương pháp lấy mẫu đã sử dụng (nếu biết);
d) tên và chữ ký của người phân tích;
e) ngày nhận mẫu;
f) kết quả thu được và đơn vị biểu thị;
g) chi tiết quan sát được trong khi thử nghiệm;
h) mọi chi tiết thao tác không qui định trong tiêu chuẩn này, hoặc tùy ý lựa chọn cùng với các có thể ảnh hưởng tới kết quả.
Phụ lục A
(tham khảo)
Các ví dụ về sắc đồ HPLC
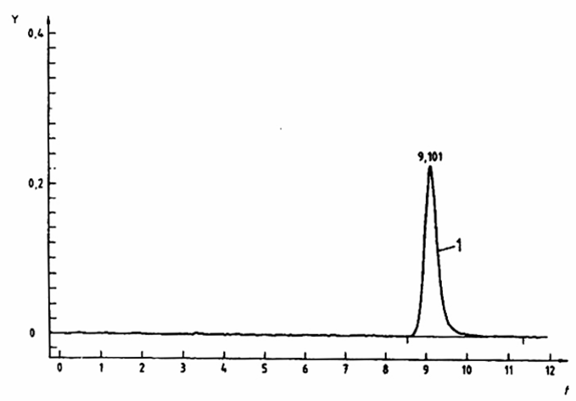
Pha tĩnh: Lichrospher® RP Select B, 5 μm, 250 mm x 4,0 mm
Pha động: Metanol (4.2.1): đệm axetat (4.2.22) (40:60)
Tốc độ dòng: 0,7 ml/min
Thể tích bơm: 20 μl
Phát hiện: Huỳnh quang: bước sóng kích thích là 366 nm; bước sóng phát xạ là 435 nm.
Hình 1 – Ví dụ về tách bằng HPLC của thiamin theo chuẩn thiocrom sử dụng dẫn xuất trước cột
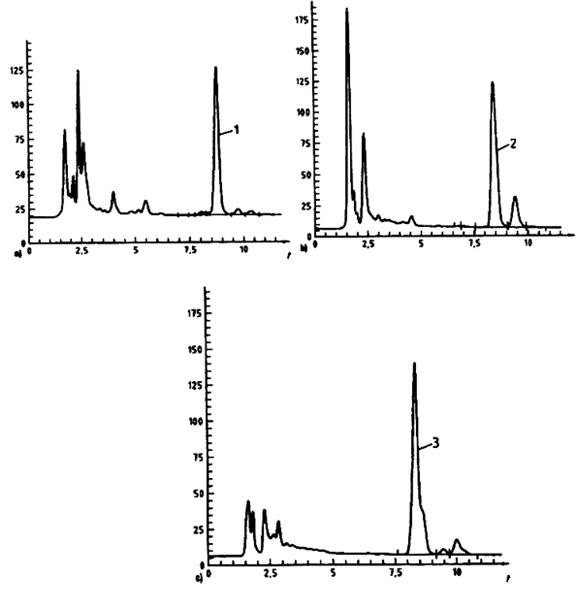
Pha tĩnh: Purospher® RP C18, được đậy nắp ở cuối, 5 μm, 250 mm x 4,6 mm
Pha động: Metanol (4.2.1): đệm phosphat, pH 3,5, c(NH4H2PO4) = 10 mmol/l, chứa 1 g/l tetraetylamoniclorua (4.2.20) và 5 mmol/l natri heptanesulfonat (4.2.21), (35:70)
Tốc độ dòng: 1,5 ml/min
Thể tích bơm: 3 μl
Thuốc thử sau cột: dung dịch kali hexaxyanoferat III kiềm (4.2.14)
Tốc độ dòng thuốc thử: 0,3 ml/min
Phát hiện: Huỳnh quang: bước sóng kích thích là 365 nm; bước sóng phát xạ là 435 nm.
Hình 2 – Ví dụ về tách bằng HPLC của chuẩn thiamin sử dụng dẫn xuất sau cột trong rau diếp (a), cơm (b) và thịt lợn luộc (c)
Phụ lục B
(Tham khảo)
Dữ liệu về độ chụm
Theo những chỉ dẫn nghiên cứu chứng nhận EU SMT, các dữ liệu đưa ra trong Bảng B.1 đã được xác định trong một phép thử liên phòng thử nghiệm [9]. Viện nghiên cứu thực phẩm, Norwich, UK thay mặt cho Ủy ban EU tham gia nghiên cứu này. Các dữ liệu đưa ra trong Bảng B.2 và Bảng B.3 đã được xác định trong một phép thử liên phòng thử nghiệm của Pháp [5].
Bảng B.1 – Dữ liệu về độ chụm đối với bột mì thô, sữa bột, rau hỗn hợp và gan lợn
|
Mẫu |
CRM 121 (bột mì thô) |
CRM 421 (sữa bột) |
CRM 485 (rau hỗn hợp) |
CRM 487 (gan lợn) |
|
Năm thử nghiệm |
1996 |
1996 |
1996 |
1996 |
|
Số phòng thử nghiệm |
13 |
14 |
12 |
15 |
|
Số lượng mẫu |
2 |
2 |
2 |
2 |
|
Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ |
13 |
14 |
12 |
15 |
|
Số ngoại lệ |
0 |
0 |
0 |
0 |
|
Số kết quả được chấp nhận |
65 |
70 |
58 |
72 |
|
Giá trị trung bình |
0,452 |
0,645 |
0,295 |
0,807 |
|
Độ lệch chuẩn của giá trị trung bình, mg/100 g |
0,054 |
0,086 |
0,039 |
0,182 |
|
Độ lệch chuẩn lặp lại, sr |
0,015 |
0,025 |
0,012 |
0,031 |
|
Hệ số biến thiên lặp lại |
3,2% |
3,8% |
4,2% |
3,9% |
|
Giá trị lặp lại r [r = 2,83 x sr], mg/100g |
0,043 |
0,071 |
0,039 |
0,088 |
|
Độ lệch chuẩn tái lập, sR, (mg/100 g) |
0,053 |
0,085 |
0,063 |
0,182 |
|
Hệ số biến thiên tái lập |
11,8% |
13,2% |
13,3% |
22,6% |
|
Giá trị tái lập R [R = 2,83 x sR), mg/100 g |
0,190 |
0,243 |
0,178 |
0,623 |
Bảng B.2 – Dữ liệu về độ chụm đối với thức ăn đóng chai dạng dung dịch, thức ăn cho trẻ em, sữa bột, bột trộn trái cây và nấm
|
Mẫu |
Dung dịch thức ăn trong chai |
Thức ăn cho trẻ em |
Sữa bột |
Bột trộn trái cây |
Nấm |
|
Năm nghiên cứu |
1995 |
1995 |
1995 |
1995 |
1995 |
|
Số phòng thử nghiệm |
10 |
10 |
10 |
10 |
10 |
|
Số lượng mẫu |
1 |
1 |
1 |
1 |
1 |
|
Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ |
8 |
10 |
10 |
10 |
10 |
|
Số ngoại lệ |
2 |
0 |
0 |
0 |
0 |
|
Số kết quả được chấp nhận |
16 |
20 |
20 |
20 |
20 |
|
Giá trị trung bình |
0,11 |
0,2 |
0,56 |
1,04 |
1,31 |
|
Độ lệch chuẩn lặp lại, sr |
0,01 |
0,02 |
0,04 |
0,07 |
0,12 |
|
Hệ số biến thiên lặp lại |
7% |
8% |
7% |
7% |
9% |
|
Giá trị lặp lại r [r = 2,83 x sr], mg/100g |
0,02 |
0,05 |
0,1 |
0,2 |
0,34 |
|
Độ lệch chuẩn tái lập, sR, (mg/100 g) |
0,04 |
0,04 |
0,08 |
0,19 |
0,17 |
|
Hệ số biến thiên tái lập |
32% |
21% |
16% |
19% |
13% |
|
Giá trị tái lập R [R = 2,83 x sR), mg/100 g |
0,1 |
0,12 |
0,25 |
0,55 |
0,48 |
Bảng B.3 – Dữ liệu về độ chụm đối với ngũ cốc, bột sôcôla và thức ăn bổ sung
|
Mẫu |
Ngũ cốc |
Ngũ cốc |
Bột sôcôla |
Thức ăn bổ sung |
|
Năm nghiên cứu |
1995 |
1995 |
1995 |
1995 |
|
Số phòng thử nghiệm |
10 |
10 |
10 |
10 |
|
Số lượng mẫu |
1 |
1 |
1 |
1 |
|
Số phòng thử nghiệm còn lại sau khi trừ ngoại lệ |
9 |
9 |
9 |
9 |
|
Số ngoại lệ |
1 |
1 |
1 |
1 |
|
Số kết quả được chấp nhận |
18 |
18 |
18 |
18 |
|
Giá trị trung bình |
1,42 |
2,95 |
1,55 |
486 |
|
Độ lệch chuẩn lặp lại, sr |
0,06 |
0,18 |
0,13 |
39 |
|
Hệ số biến thiên lặp lại |
4% |
6% |
8% |
8% |
|
Giá trị lặp lại r [r = 2,83 x sr], mg/100g |
0,16 |
0,49 |
0,36 |
111 |
|
Độ lệch chuẩn tái lập, sR, (mg/100 g) |
0,27 |
0,41 |
0,28 |
75 |
|
Hệ số biến thiên tái lập |
19% |
14% |
19% |
15% |
|
Giá trị tái lập R [R = 2,83 x sR), mg/100 g |
0,75 |
1,16 |
0,8 |
212 |
Phụ lục C
(tham khảo)
Hệ thống HPLC thay thế
Việc tách và định lượng được chứng minh là thích hợp nếu áp dụng các điều kiện về sắc ký như sau [9]:
Bảng C.1 – Điều kiện HPLC thay thế
|
Pha cố định |
Kích thước cột mm x mm |
Pha động (V:V) |
Sự
tách sóng (Ex/Em) |
Lưu lượng ml/min |
Kiểu oxi hóa |
|
Radial silica® 10 μm |
250 x 4,6 |
Etanol/dung dịch đệm phosphat pH = 7,4 c(K2HPO4) = 0,1 mol/l (50:50) |
F: 365/435 |
3,0 |
PCa |
|
Supelco® LC-18-DB 5 μm |
250 x 4,6 |
Metanol/dung dịch đệm phosphat pH = 3,5 c(K2HPO4) = 9 mmol/l chứa tetraetylamoniumclorua, ρ(C8H20NCl) = 1 g/l và natri heptansulfonat, c(C7H15NaO3S) = 5 mmol/l (35:65) |
F: 368/420 |
1,0 |
PC |
|
Lichrospher® RB 18 5 μm |
250 x 4,6 |
Metanol/natri hexansulfonat, c(C6H13NaO3S.H2O) = 1 mmol/l, pH = 3,0 (70:30) |
F: 375/435 |
1,5 |
PC |
|
Eurospher® 100 – C18 5 μm |
250 x 4,6 |
Natri dihydrophosphat, c(NaH2PO4) = 10 mmol/l): natri perclorat, c(NaClO4) = 0,15 mol/l (50:50) |
F: 375/435 |
1,0 |
PC |
|
Lichrospher® RP Select B 5 μm |
250 x 4,6 |
Metanol/dung dịch đệm axetat pH = 4,0, c(CH3COONa) = 50 mmol/l (40:60) |
F: 366/435 |
0,7 |
PRCb |
|
μ-Bondapak® radial C18 5 μm |
250 x 4,6 |
Metanol/dung dịch đệm axetat pH = 4,5, c(CH3COONa) = 0,5 mmol/l (40:60) |
F: 366/435 |
0,8 |
PRC |
|
Spherisorb® ODS2 5 μm |
250 x 4,6 |
Metanol/dung dịch đệm phosphat pH = 4,0, c(KH2PO4) = 0,1 mol/l (70:30) |
F: 375/435 |
1,0 |
PRC |
|
Lichrospher® RP 18 10 μm |
250 x 4,6 |
Kali dihydrophosphat, c(KH2PO4) = 10 mmol/l/dimetyl formamit (80:20) |
F: 368:440 |
1,5 |
PRC |
|
Hamilton® PRP-1 5 μm |
150 x 4,6 |
Metanol/nước (40:60); pH được điều chỉnh tới 4,5 bằng axit axetic |
F: 366/435 |
1,0 |
PRC |
|
Hamilton® PRP-1 5 μm |
150 x 4,1 |
Metanol/nước (35:65); pH = 9,0 được điều chỉnh bằng amoniac, w(NH3) = 25% |
F: 366/435 |
1,0 |
PRC |
|
Hypersil® NH2APS 2 5 μm |
250 x 4,6 |
Diclometan/metanol (95:5) |
F: 365/435 |
1,0 |
PRC |
|
a PC = Dẫn xuất sau cột. b PRC = Dẫn xuất trước cột. |
|||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Bognár, A.: Bcstimmung von Riboflavin und Thiamin in Lebensrnitteln mil Hilfe dor Hochleistungs- flussigkeitschromatographie (HPLC) Deutsche Lebensm. Rundschau 77. 1981. 431-436.
[2] Hasselmann. C. Franck, D., Grimm. P.. Diop, P.A. and Soules. C: High-peiiormance liquid chromatographic analysis of thiamin and riboflavin in dietic foods. J. Micronutr. Anal. 5. 1989. 269-279.
[3] Bognar, A.: Determination of vitamin B1 in food by High-Performance-Liquid-Chromatography and post-column derivatization. Fresenius J. Anal. Chem. 343.1992. 155-56.
[4] Hagg. M. and Kumpulainen. J.: Thiamin and riboflavin contents in domestic and imported cereal products in Finland. J. Food Comp. Anal. 6, 1993. 299-306.
[5] Arella, P., Lahely, S., Bourguignon, J. B. and Hasselmann, C.: Liquid chromatographic determination of vitamin B1 and B2 in foods. A collaborative study. Food Chem 56. 1996. 81-86.
[6] Eitenmiller, R. R. and Landen. W. O: Vitamin Analysis for the Health and Food Sciences. CRC Press. Boca Raton. London, New York. Washington. D.C., 1999, 271-297.
[7] Dawson. R.M.C.. Elliott. D C, Elliot. W. H. and Jones. K.: Data lor Biochemical Research. Oxford Science Publication 3rd. ISBN 019 855299 8,1989.
[8] Hagg. M.: Effect of various commercially available enzymes in the liquid chromatographic determination with external standardization of thiamin and riboflavin in foods J. AOAC Int. 77. 1994, 681-686.
[9] Finglas, P. M., Scott., K. J.. Witthoft, C. M., van den Berg, H. and de Froidmont-Gortz, I.: Ihe certification of the mass fractions of vitamins in four reference materials: Whoiomeal flour (CRM 121), milk powder (CRM 421), lyophilised mixed vegetables (CRM 485) and lyophilised pig's liver (CRM 487) EUR-report 18320. Office for Official Publications of the European Communities. Luxembourg, 1999.
[10] Takasht, U. Yukiko, T., Kohei, M., Mari, T. Kaname, K.: Simultaneous determination of 2(1- hydroxyethyl)thiamin and thiamin in foods by high performance liquid chromatography with postcolumn derivatisation. Vitamins (Japan). 64. 1990. 379-385.
[11] Takashi, U., Yukiko, T., Kohei, M., Masako, M., Kaname, K.: Distribution and stability of 2(1- hydroxyethyl)thiamin and thiamin in foods. Vitamins (Japan). 65.1991, 249-256.
1) Taka-Diastase Nr. T00040 là tên thương mại của sản phẩm được cung cấp bởi Pfaltz & Bauer, Waterbury, CT 06708, Mỹ. Thông tin này đưa ra tạo thuận lợi cho người sử dụng tiêu chuẩn này và CEN không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
2) Cột silica bao gói vật liệu thích hợp có bán sẵn là Lichrosorb® Si 60, Spherisorb® Si, Hypersil® Si và Lichrospher® 100 DIOL. Các cột RP bao gói vật liệu thích hợp như Spherisorb® ODS, μ-Bondapak® radial C18, Supelco® LC-18-DB và Hypersil® ODS. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn này và CEN không ấn định phải sử dụng chúng.

