Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6404:1998 (ISO 7218 : 1997 ) về Vi sinh vật trong thực phẩm và trong thức ăn gia súc - Nguyên tắc chung về kiểm tra vi sinh vật do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6404 : 1998
VI SINH VẬT TRONG THỰC PHẨM VÀ TRONG THỨC ĂN GIA SÚC - NGUYÊN TẮC CHUNG VỀ KIỂM TRA VI SINH VẬT
Microbiology of food and animal feeding stuffs - General rules for microbiological examinations
Lời nói đầu
TCVN 6404 : 1998 hoàn toàn tương đương với ISO 7218 : 1997 (E)
TCVN 6404 : 1998 do ban kỹ thuật tiêu chuẩn TCVN/TC/F12 Sữa và sản phẩm sữa biên soạn, Tổng cục Tiêu chuẩn - Đo lường - Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
VI SINH VẬT TRONG THỰC PHẨM VÀ TRONG THỨC ĂN GIA SÚC - NGUYÊN TẮC CHUNG VỀ KIỂM TRA VI SINH VẬT
Microbiology of food and animal feeding stuffs - General rules for microbiological examinations
1 Phạm vi áp dụng
Tiêu chuẩn này đưa ra các chỉ dẫn về cách tiến hành kiểm tra vi sinh vật phù hợp với các tiêu chuẩn riêng rẽ.
Mục đích của tiêu chuẩn này là giúp đảm bảo tính hợp thức của công việc kiểm tra nhằm xác định tính đồng nhất của các kỹ thuật chung sử dụng trong kiểm tra ở tất cả các phòng thí nghiệm, giúp đạt được các kết quả đồng nhất nhất tại các phòng thí nghiệm khác nhau và bảo vệ sức khỏe của nhân viên phòng thí nghiệm bằng cách ngăn ngừa các nguy cơ truyền nhiễm.
Tiêu chuẩn này có thể được sử dụng toàn bộ hoặc từng phần trong việc công nhận phòng thí nghiệm của các cơ quan quốc gia.
2 Tiêu chuẩn trích dẫn
ISO 6887 : 1983, Vi sinh vật học - Hướng dẫn chung về việc chuẩn bị các dung dịch pha loãng để kiểm tra vi sinh vật.
3 Cơ sở thử nghiệm
3.1 Khu vực thử nghiệm
Các khu vực cần có cho hoạt động đặc thù của phòng thí nghiệm vi sinh vật như sau:
- nơi nhận, nơi bảo quản, nơi chuẩn bị và xử lý mẫu;
- chuẩn bị và khử trùng môi trường nuôi cấy và dụng cụ;
- tiến hành phân tích: cân, pha loãng, cấy, cấy truyền, nuôi ấm, bảo quản các chủng v.v...
- khử nhiễm và làm sạch thiết bị, và xử lý các chất thải sau phân tích.
3.2 Khu vực phụ trợ
Các khu vực thuộc phạm trù này bao gồm:
- lối vào, hành lang, cầu thang, thang máy chở hàng hoặc thang máy;
- khu vực hành chính (thí dụ như: phòng thư ký, văn phòng, phòng tài liệu ..);
- phòng thay áo và nhà vệ sinh;
- phòng văn thư lưu trữ;
- nhà kho.
3.3 Vị trí cơ sở thử nghiệm
Môi trường trong đó tiến hành phân tích vi sinh vật phải không ảnh hưởng đến độ tin cậy của phép phân tích.
Phải chú ý tới vị trí của cơ sở thử nghiệm sao cho tránh nguy cơ tạp nhiễm chéo. Để đạt được điều đó có thể áp dụng nguyên tắc "đường một chiều".
Phải chú ý đảm bảo việc bảo vệ khỏi các điều kiện vượt quá sự cho phép như nhiệt độ, bụi, độ ẩm, hơi nước, tiếng ồn, độ rung, ánh sáng mặt trời chiếu thẳng...
Mặt bằng khu vực phải đủ rộng để giữ được vệ sinh và ngăn nắp. Đối với tất cả các cơ sở thử nghiệm, nên có khoảng 20 m2 diện tích làm việc cho mỗi phân tích viên.
Trong khi tiến hành thử nghiệm, cần chú ý hạn chế việc qua lại khu vực thử nghiệm, chỉ dành cho những người cần thiết để thực hiện thử nghiệm.
Cần có các phòng riêng biệt và/hoặc các khu vực riêng biệt và/hoặc các khu được khoanh vùng riêng dành cho việc:
- nhận mẫu và bảo quản mẫu:
- chuẩn bị mẫu, đặc biệt trong trường hợp nguyên liệu thô (thí dụ như sản phẩm dạng bột có chứa số lượng lớn vi sinh vật);
- thao tác với vi sinh vật gây bệnh (thí dụ Salmonella, Listeria monocytogenes);
- chuẩn bị và khử trùng môi trường nuôi cấy, dụng cụ;
- rửa dụng cụ thủy tinh và các dụng cụ khác, cũng như khử nhiễm dụng cụ và môi trường nuôi cấy;
- kiểm tra độ vô trùng của thực phẩm.
Cũng cần cách ly các khu vực sau:
- khu vực dùng để chuẩn bị môi trường nuôi cấy và phòng dùng để khử trùng môi trường nuôi cấy và dụng cụ; và
- khu vực khử nhiễm sau thử nghiệm và khu vực rửa.
Tủ ấm, tủ lạnh và tủ đá có thể đạt được đặt trong các phòng đặt biệt, chuyên dụng.
3.4 Trang bị cho cơ sở thử nghiệm
3.4.1 Cơ sở thử nghiệm phải được trang bị như sau để giảm bớt nguy cơ nhiễm bẩn do bụi kép theo vi sinh vật:
- tường, trần và sàn nhà phải nhẵn trơn, dễ rửa và chịu được các chất tẩy rửa và các chất khử trùng dùng trong phòng thí nghiệm;
- các đường ống dẫn nước quá nóng ngang qua cơ sở thử nghiệm trừ khi chúng được bọc kín;
- cần lắp hệ thống bảo vệ chống bức xạ mặt trời ở phía ngoài các cửa sổ, trừ một số trường hợp đặc biệt;
- các cửa ra vào và cửa sổ cần được đóng kín khi đang tiến hành thử để ngăn gió lùa; ngoài ra chúng phải được thiết kế sao cho chống được bụi bám và dễ lau rửa.
3.4.2 Nhiệt độ môi trường và chất lượng không khí (mật độ vi sinh vật, độ ẩm, mức bụi tỏa lan, v.v.) phải tương hợp với tiến trình thử. Để đạt mục đích này nên dùng hệ thống lọc không khí tại đầu vào của luồng khí.
Khi phép thử được tiến hành trong 1 môi trường hơi nhiễm bẩn, thì phòng thử nghiệm phải được trang bị đặc biệt, với một tủ cấy thổi không khí sạch và/hoặc 1 tủ an toàn.
Thiết bị này phải phù hợp với các qui định có liên quan.
3.4.3 Mặt bàn và các trang bị của phòng thí nghiệm phải được chế tạo bằng vật liệu nhẵn trơn, không thấm, dễ làm sạch và khử trùng. Để tránh tích bụi, các tủ tường phải được bố trí cao chạm trần, nếu có thể đạt được.
Các trang bị của phòng thí nghiệm phải được thiết kế sao để thuận tiện cho việc lau rửa sàn nhà (thí dụ, các trang bị thử nghiệm có thể di động được).
Các phương tiện bảo quản kín phải thích hợp để bảo quản tài liệu sử dụng khi tiếp xúc với mẫu, môi trường nuôi cấy, hóa chất v.v.
Chú thích - Các tài liệu hoặc sách không dùng thường xuyên nên để bên ngoài khu vực thử nghiệm.
3.4.4 Cơ sở thử nghiệm cần được chiếu sáng tốt và tránh được nhiễu phản xa. Đặc biệt để tránh ánh sáng mặt trời chiếu thẳng vào các vị trí làm việc và các thiết bị nhạy cảm (đặc biệt là tủ ấm).
3.5 Bảo quản và kiểm tra
Mặt sàn, tường, trần, mặt bàn và các trang bị của phòng thí nghiệm phải được bảo dưỡng thường xuyên và sữa chữa để tránh nứt rạn dẫn đến bụi bẩn có thể tích tụ và gây ra nhiễm bẩn.
Cần thường xuyên phải thực hiện lau rửa và sát trùng để giữ cho các phòng luôn trong trạng thái thích hợp để tiến hành thử nghiệm.
Hệ thống thông gió và các bộ lọc của chúng cần được bảo dưỡng thường xuyên và thay các bộ lọc khi cần.
Phải kiểm tra định kỳ độ sạch về vi sinh vật trên mặt bàn làm việc và của không khí.
Độ nhiễm bẩn bề mặt có thể được đánh giá bằng cách áp trực tiếp tấm lấy mẫu đã tẩm chất trung hòa thích hợp nên bề mặt. Chất lượng không khí có thể được kiểm tra bằng cách đặt một đĩa Petri mở nắp đã chứa môi trường thạch không chọn lọc (thí dụ: thạch đếm tổng số PAC) trong 15 phút.
Chú thích - Có thể dùng các phương pháp khác để xác định độ nhiễm bẩn của bề mặt và không khí.
4 Lắp đặt và trang bị
Nhìn chung, tất cả máy móc và thiết bị phải được giữ sạch sẽ và trong điều kiện làm việc tương thích. Các hoạt động bảo dưỡng cần được kiểm tra. Các trang thiết bị để kiểm tra phải luôn sẵn sàng.
4.1 Tủ cấy vi sinh vật
4.1.1 Mô tả
Tủ là 1 chỗ làm việc loại trừ được bụi, được trang bị luồng khí thổi, thổi theo chiều ngang hoặc chiều dọc. Về mặt vi sinh vật, tủ an toàn được dùng để giữ lại các vi sinh vật trên các tấm lọc.
Theo qui ước, số lượng tối đa các hạt với kích thước lớn hơn 0,5 mm có trong một mét khối là thể hiện cấp loại hút bụi của tủ an toàn. Đối với loại tủ dùng trong vi sinh thực phẩm, số lượng hạt không được vượt quá 4000 trong một mét khối.
Có hai loại tủ:
a) tủ không khí sạch dùng để bảo vệ sản phẩm khỏi sự nhiễm bẩn từ bên ngoài, và để giảm sự thiếu tạp nhiễm do kỹ thuật viên gây ra.
b) tủ an toàn, dùng để bảo vệ sản phẩm khỏi sự nhiễm bẩn từ bên ngoài, cũng như bảo vệ kỹ thuật viên và bảo vệ môi trường.
Tủ an toàn phải được sử dụng cho mọi công việc có liên quan với vi sinh vật gây bệnh.
4.1.2 Bảo dưỡng và kiểm tra
Tính hiệu quả của tủ an toàn phải được 1 nhân viên có chuyên môn kiểm tra khi tiếp cận và kiểm tra thường xuyên sau đó (nên kiểm tra hàng năm). Nếu tủ có lưới lọc sơ bộ thì cần thường xuyên thay lưới lọc này.
Tủ phải được làm vệ sinh và sát trùng sau khi sử dụng. Cần tiến hành kiểm tra thường xuyên về độ nhiễm vi sinh bằng 1 xét nghiệm bề mặt làm việc và thành tủ.
Việc kiểm tra thường xuyên tỷ lệ vi sinh vật có mặt được tiến hành với trang bị thông thường. Thí dụ, trong mỗi tủ đặt vài đĩa Petri mở nắp đã chứa 1 môi trường nuôi cấy thạch không chọn lọc (thí dụ PCA) trong 30 phút. Cũng có thể dùng các phương pháp khác.
4.2 Cân
4.2.1 Tính năng sử dụng
Phòng thí nghiệm vi sinh vật thực phẩm phải được trang bị các cân với phạm vi cân và độ chính xác cần thiết để cân các loại sản phẩm khác nhau. Nhìn chung, cần có hai độ chính xác là: ± 0,01g và ± 0,0001g.
Những cân này chủ yếu dùng để cân phần mẫu thử cần phân tích và các thành phần của môi trường nuôi cấy và thuốc thử. Chúng cũng có thể được dùng để đo các thể tích dung dịch pha loãng bằng cách cân.
4.2.2 Bảo dưỡng và kiểm tra
Cân phải được đặt trên giá nằm ngang vững chắc và chống rung.
Cần kiểm tra thường xuyên bằng cách hiệu chuẩn theo các chuẩn công tác (tốt nhất là mỗi ngày làm việc một lần). Tối thiểu mỗi năm một lần, nhân viên có chuyên môn kiểm tra toàn bộ giải làm việc của cân.
Làm sạch đĩa cân sau mỗi lần dùng, nếu cần, và tối thiểu mỗi ngày một lần. Các kết cấu cơ khí phải được làm sạch và được nhân viên có chuyên môn kiểm tra tối thiểu mỗi năm một lần.
4.3 Thiết bị đồng hóa mẫu
4.3.1 Mô tả
Thiết bị này dùng để chuẩn bị huyền phù ban đầu từ mẫu thử của sản phẩm không ở dạng lỏng.
Có thể dùng các thiết bị sau:
- thiết bị đồng hóa kiểu nhu động với các túi chất dẻo vô trùng, có thể kèm độ điều chỉnh tốc độ và thời gian; hoặc
- thiết bị đồng hóa kiểu quay, có tốc độ quay từ 8000 vòng/phút đến 45000 vòng/phút, kèm theo bình chứa co nắp bằng kim loại hoặc thủy tinh và có thể khử trùng được.
Trong một vài trường hợp đặc biệt, việc đồng hóa có thể được tiến hành với các viên bi thủy tinh khử trùng được và có đường kính thích hợp (khoảng 6 mm; xem các tiêu chuẩn riêng).
4.3.2 Tính năng sử dụng
Thời gian hoạt động thông thường của trang thiết đồng hóa kiểu nhu động khoảng 1 phút đến 2 phút. Loại thiết bị này không dùng được cho một số thực phẩm như:
- các sản phẩm có thể làm thủng túi (có các hạt nhọn sắc, cứng, khô), hoặc
- các sản phẩm khó đồng hóa do cấu trúc của chúng (thí dụ xúc xích).
Thiết bị đồng hóa kiểu quay có thể vận hành trong một khoảng thời gian có số vòng quay từ 15000 đến 20000. Nhưng với thiết bị đồng hóa chậm nhất thì thời gian vận hành cũng không được vượt quá 2,5 phút.
Các bi thủy tinh có thể được dùng để chuẩn bị các huyền phù ban đầu cho một vài sản phẩm có độ nhớt hoặc sản phẩm đặc nhất định, đặc biệt là đối với sản phẩm sữa thì sử dụng bằng cách lắc (xem các tiêu chuẩn cụ thể).
4.3.3 Bảo dưỡng và kiểm tra
Các dụng cụ và thiết bị khác nhau cần được kiểm tra và bảo dưỡng theo chỉ dẫn của các nhà sản xuất .
4.4 pH mét
4.4.1 Mô tả
pH mét dùng để đo hiệu thế ở nhiệt độ xác định giữa điện cực đo và điện cực so sánh, cả hai điện cực đều được đưa vào sản phẩm. pH mét này có thể đo chính xác đến ± 0,1 đơn vị pH và có những ngưỡng đo tối thiểu là 0,01 pH. pH mét phải gắn với bộ cân bằng nhiệt bằng tay hoặc tự động.
Chú thích - Điện cực đo và điện cực so sánh thường được gắn với nhau thành hệ thống điện cực hợp.
4.4.2 Tính năng sử dụng
pH mét được dùng để đo pH của mỗi mẻ môi trường nuôi cấy và thuốc thử (7.2) để kiểm tra xem có cần điều chỉnh không. Nó cũng có thể được sử dụng để đo và / hoặc điều chỉnh pH của mẫu thử hoặc pH của huyền phù ban đầu. Việc sử dụng pH mét sẽ được thảo luận trong tiêu chuẩn cụ thể của sản phẩm cần phân tích, trong đó các điều kiện để xác định pH, để điều chỉnh pH cũng như phương pháp làm sạch và khử nhiễm các điện cực sẽ được qui định cụ thể.
4.4.3 Bảo dưỡng và kiểm tra
Hàng ngày phải hiệu chuẩn pH mét theo hướng dẫn của nhà sản xuất, dùng ít nhất là hai dung dịch đệm chuẩn. Các dung dịch chuẩn có các giá trị pH biết trước chính xác tới hai số sau dấu phẩy ở nhiệt độ đo (nói chung pH 4,00 và pH 7,00 ở nhiệt độ 20oC) phải bao trùm các giá trị pH cần đo.
Cần vảo dưỡng và kiểm tra các điện cực theo các hướng dẫn của nhà sản xuất. Điều cần kiểm tra thường xuyên:
- tình trạng các điện cực về mức độ bẩn và lão hóa;
- thời gian cho kết quả và độ ổn định.
Trước mỗi lần sử dụng, hãy kiểm tra đầu đo của các điện cực đã ngập hoàn toàn trong nước cất hoặc chất lỏng khác chưa, theo như chỉ dẫn của nhà sản xuất; hoặc là ngâm 24h trước khi đo.
Rửa sạch các điện cực sau mỗi lần sử dụng. Để đánh giá mức bẩn và mức độ lão hóa của các điện cực đo, phải thường xuyên rửa các điện cực thật sạch theo hướng dẫn của nhà sản xuất.
Bảo quản các điện cực theo hướng dẫn của nhà sản xuất.
4.5 Nồi hấp áp lực
4.5.1 Mô tả
Nồi hấp áp lực là một thiết bị cho phép nhiệt độ của hơi nước bão hòa đến ít nhất là 121oC để giết chết các vi sinh vật.
4.5.2 Tính năng sử dụng
Trong cùng một chu kỳ khử trùng, nồi hấp áp lực không được sử dụng để khử trùng các dụng cụ sạch (và/hoặc môi trường nuôi cấy) cùng lúc với khử bẩn các dụng cụ đã sử dụng (và/hoặc môi trường nuôi cấy đã sử dụng). Tốt hơn là sử dụng các nồi hấp áp lực riêng biệt cho hai quá trình này.
Nồi hấp áp lực phải có:
- ít nhất một van an toàn;
- một áp kế;
- một van xả;
- một bộ điều chỉnh nhiệt độ để duy trì nhiệt độ trong khoảng ± 1oC nhiệt độ qui định;
- một nhiệt kế hoặc cập nhiệt điện tự ghi.
Nồi hấp nên gắn với một đồng hồ hoặc một bộ phận đặt chương trình/thời gian.
Để khử trùng nồi hấp phải đuổi hết không khí trước khi tạo áp lực. Nếu như nồi hấp áp lực không được gắn với một thiết bị chân không tự động, thì cần phải đuổi không khí cho đến khi ống phun luồng hơi nước liên tục phát ra.
4.5.3 Bảo dưỡng và kiểm tra
Phải giữ nồi hấp áp lực ở điều kiện làm việc tốt và phải kiểm tra thường xuyên bởi các bộ phận có năng lực và theo hướng dẫn của nhà sản xuất.
Tất cả các dụng cụ kiểm tra phải giữ trong trạng thái làm việc tốt và do bộ phận có thẩm quyền kiểm tra định kỳ theo hướng dẫn của nhà sản xuất.
Nếu cần, làm sạch gỉ và tháo nước thường xuyên.
4.6 Tủ ấm
4.6.1 Mô tả
Tủ ấm bao gồm một luồng giữ được nhiệt độ ổn định và phân phối đều đến ± 1oC nếu không có qui định nào khác.
4.6.2 Tính năng sử dụng
Các tủ ấm cần được trang bị các hệ thống điều chỉnh để giữ được nhiệt độ đều và độ ổn định trong khi sử dụng.
Nếu nhiệt độ môi trường gần bằng hoặc cao hơn nhiệt độ của tủ ấm, thì cần phải bố trí một hệ thống làm mát.
Bảo vệ các thành của tủ ấm tránh ánh sáng mặt trời chiếu thẳng.
Nếu có thể, khi sử dụng bất kỳ loại tủ ấm nào (đối lưu không khí bắt buộc hoặc không), các tủ ấm không nên để đầy quá bởi vì môi trường nuôi cấy sẽ cần nhiều thời gian hơn để cân bằng nhiệt độ.
Khi xếp mẫu vào tủ ấm phải chú ý tới sự lưu thông không khí; trong mọi tình huống các đĩa Petri hoặc các ống nghiệm để cách các thành trong tủ ấm trong vòng 25 mm. Không chống cao quá sáu đĩa Petri và các đĩa phải cách nhau ít nhất 25 mm.
4.6.3 Bảo dưỡng và kiểm tra
Nhiệt độ đồng nhất trong khi làm việc phải được kiểm tra bằng nhiệt kế hoặc bằng cặp nhiệt điện.
Độ chính xác của phép đo nên cao gấp bốn lần độ chính xác yêu cầu (thí dụ: độ chính xác yêu cầu là ± 2oC, thì độ chính xác của phép đo là ± 0,5oC).
Phải kiểm tra tính ổn định của nhiệt độ, thí dụ, bằng một hoặc nhiều giá trị lớn nhất và nhỏ nhất.
Kiểm tra nhiệt độ của tủ ấm hàng ngày làm việc. Đối với mục đích này, mỗi tủ ấm được gắn với ít nhất là một nhiệt kế, với bầu chất đo được ngâm trong glyxerol đựng trong chai gắn xi kín. Các hệ thống kiểm tra khác có tính năng tương tự có thể được sử dụng. Các vách trong và vách ngoài của tủ ấm phải được làm sạch thường xuyên và sát trùng, nếu cần thì loại bỏ bụi bẩn ở hệ thống quạt gió.
4.7 Tủ lạnh và phòng bảo quản lạnh
4.7.1 Mô tả
Đó là các tủ cho phép duy trì chế độ bảo quản lạnh. Khi không có qui định khác, nhiệt độ này phải là +3oC ± 2oC, trừ khi bảo quản mẫu phân tích nhiệt độ phải là +2oC ± 2oC.
4.7.2 Tính năng sử dụng
Phải có các tủ khác nhau để bảo quản:
- môi trường dinh dưỡng chưa cấy và thuốc thử;
- mẫu để phân tích;
- các chủng vi sinh vật và các môi trường đã cấy.
Các vật được bảo quản trong tủ lạnh và các ngăn lạnh sao cho duy trì được tuần hoàn không khí thích ứng.
4.7.3 Bảo dưỡng và kiểm tra
Mỗi ngày làm việc phải kiểm tra nhiệt độ của từng buồng bằng 1 nhiệt kế hoặc bằng 1 đầu dò được đặt cố định. (Xem 4.6.3 về độ chính xác của thiết bị này).
Phải thường xuyên thực hiện các công việc bảo dưỡng sau đây:
- lau bụi ở các cánh quạt hoặc ở các tấm trao đổi nhiệt phía ngoài;
- làm tan băng;
- làm sạch và khử trùng mặt trong của tủ.
4.8 Tủ đá
4.8.1 Mô tả
Tủ đá có các buồng lạnh cho phép duy trì chế độ bảo quản lạnh sâu. Khi không có qui định khác, nhiệt độ này phải nhỏ hơn -18oC, tốt hơn là ở -24oC ± 2oC.
4.8.2 Tính năng sử dụng
Phải có các tủ khác nhau để bảo quản:
- một vài môi trường dinh dưỡng chưa cấy và thuốc thử;
- các mẫu phân tích;
- các chủng sinh vật.
Xếp đặt trong tủ lạnh và các phỏng bảo quản lạnh sao cho duy trì được nhiệt độ đủ thấp, đặc biệt là khi đưa các sản phẩm chưa đông lạnh vào.
4.8.3 Bảo dưỡng và kiểm tra
Mỗi ngày làm việc phải kiểm tra nhiệt độ của từng buồng bằng 1 nhiệt kế hoặc bằng 1 đầu dò lắp cố định. (Xem 4.6.3 về độ chính xác của thiết bị này).
Phải thường xuyên thực hiện các công việc bảo quản dưỡng sau đây:
- lau bụi ở cánh quạt hoặc ở tấm trao đổi nhiệt phía ngoài;
- làm tan băng;
- làm sạch và sát trùng mặt trong của tủ.
4.9 Bể điều nhiệt
4.9.1 Mô tả
Bể nhiều nhiệt là bể cho phép duy trì 1 nhiệt độ xác định. Khi không có qui định khác, độ chính xác cần đạt đến ± 0,5oC. Nhiệt độ làm việc sẽ được qui định trong từng phương pháp sử dụng.
4.9.2 Tính năng sử dụng
Các tính năng sử dụng chính như sau:
- duy trì môi trường thạch tan chảy vô trùng ở 47oC ± 2oC;
- nuôi ấm môi trường đã cấy ở 1 nhiệt độ không đổi;
- chuẩn bị các dung dịch ban đầu ở 1 nhiệt độ được khống chế (thí dụ, chuẩn bị các huyền phù caseinat đòi hỏi phải duy trì 15 phút trong bể ở nhiệt độ 37oC);
- xử lý các huyền phù ban đầu ở một nhiệt độ khống chế (thí dụ, việc đếm các bào tử có thể cần phải loại bỏ hết các tế bào dinh dưỡng).
Để kiểm tra nhiệt độ chính xác, bể điều nhiệt cần được trang bị 1 bơm nước tuần hoàn và 1 hệ thống điều nhiệt tự động. Việc khuấy trộng chất lỏng này không được gây ra các giọt nhỏ phân tán.
4.9.3 Bảo dưỡng và kiểm tra
Mỗi bể được gắn với một nhiệt kế hoặc một cặp nhiệt điện độc lập của hệ thống điều nhiệt tự động.
Kiểm tra nhiệt độ của bể mỗi lần sử dụng, tốt nhất là kiểm tra hàng ngày.
Kiểm tra thường xuyên mức chất lỏng trong bể (nước, etylen glycol...).
Để tránh sự bội nhiễm vi khuẩn phải thường xuyên thay chất lỏng này.
4.10 Tủ sấy khử trùng
4.10.1 Mô tả
Tủ sấy khử trùng là một buồng duy trì được nhiệt độ từ 170oC đến 180oC để giết các vi sinh vật bằng nhiệt khô.
4.10.2 Tính năng sử dụng
Chỉ khử trùng thiết bị bằng kim loại hoặc bằng thủy tinh trong tủ sấy khử trùng. Thời gian khử trùng ít nhất là 1h, kể từ khi đạt được nhiệt độ cần thiết.
Cảnh báo - Dụng cụ thủy tinh đo thể tích không được khử trùng trong tủ sấy này.
Nhiệt độ cần phân bố đều trong buồng sấy.
Tủ sấy phải được trang bị:
- bộ ổn nhiệt
- 1 nhiệt kế hoặc cặp nhiệt điện tự ghi.
Tốt nhất là được gắn với đồng hồ hoặc bộ phận đặt chương trình/thời gian.
4.10.3 Bảo dưỡng và kiểm tra
Kiểm tra tính đồng nhất của nhiệt độ trong từng buồng làm việc.
Giữ tủ ở trạng thái làm việc tốt và các dụng cụ kiểm tra phải được kiểm định thường xuyên.
Nên thường xuyên làm vệ sinh tủ.
4.11 Lò vi sóng
4.11.1 Mô tả
Lò vi sóng là máy dùng sóng cực ngắn để làm nóng sản phẩm.
4.11.2 Tính năng sử dụng
Hiện tại, chỉ có một khả năng sử dụng: làm tan chảy môi trường thạch nuôi cấy.
Thiết bị được sử dụng để hoạt động ở chế độ áp suất khí quyển. Nó có thể đun nóng các môi trường nuôi cấy bằng 1 chu trình phát sóng cực ngắn kiểm soát được. Việc phân bố sóng cực ngắn phải đồng đều trong sản phẩm để tránh có những vùng bị quá nhiệt. Để phân bố nhiệt được tốt hơn nên sử dụng thiết bị có gắn bệ xoay.
Cảnh báo - Việc gia nhiệt môi trường thạch nuôi cấy trong lò vi sóng có thể làm sôi chậm.
Chú thích - Khi còn thiếu sự đánh giá đầy đủ về hiệu quả khử trùng các môi trường nuôi cấy của lò vi sóng, thì khả năng sử dụng này chưa được qui định ở đây.
4.12 Kính hiển vi quang học
4.12.1 Tính năng sử dụng
Kính hiển vi quang học gồm có các vật kính với độ khuếch đại khác nhau. Dùng vật kính có độ khuếch đại cao nhúng chìm trong dầu cho phép quan sát hình thái của vi sinh ở dạng huyền phù trong nước hoặc sau khi nhuộm màu. Tốt hơn là kính hiển vi nên có 1 vật tương phản pha và bộ phận tụ quang chia tầng để tạo thuận lợi cho việc kiểm tra các vi sinh vật còn sống.
Chú thích - Các thiết bị (các kính lúp) có độ khuếch đại thấp và kính hiển vi lập thể điều chỉnh được tiêu điểm có thể sử dụng để kiểm tra các khuẩn lạc ở trên, hoặc trong môi trường thạch nuôi cấy.
4.12.2 Bảo dưỡng và kiểm tra
Sau khi sử dụng vật kính soi dầu, rửa sạch thấu kính sao cho không làm ảnh hưởng đến chất lượng quang học, để loại bỏ hết dầu còn dính.
Ít nhất là hàng năm, 1 nhân viên có thẩm quyền tiến hành việc làm sạch, kiểm tra các phần cơ và quang học.
4.13 Đèn đốt bằng ga hoặc lò đốt nóng bằng điện trở
Đèn đốt bằng ga được dùng để tạo ra và duy trì 1 vùng bảo vệ quanh điểm nóng. Được dùng để khứ trùng các que hàn và các vòng cấy kim loại bằng cách đốt đến nóng đỏ.
Lò đốt nóng bằng điện trở là thích hợp để khử trùng các kim loại hoặc các vòng cấy bằng kim loại sau khi thao tác với vi khuẩn gây bệnh.
4.14 Dụng cụ phân phối môi trường nuôi cấy và thuốc thử
4.14.1 Mô tả
Dụng cụ phân phối môi trường nuôi cấy và thuốc thử là một dụng cụ hay thiết bị dùng để phân phối môi trường nuôi cấy và thuốc thử và các ống nghiệm, các lọ hoặc vào các đĩa Petri (thí dụ, ống đong, xilanh thao tác bằng tay, xilanh tự động, bơm nhu động hoặc bơm cơ học cung cấp tự động).
4.14.2 Tính năng sử dụng
Trong trường hợp phân phối vô trùng các môi trường nuôi cấy 1 cách vô trùng và thuốc thử, tất cả các bộ phận của dụng cụ hay của thiết bị tiếp xúc với sản phẩm phân phối phải vô trùng (xem 6.2).
Độ chính xác của dụng cụ hay thiết bị phải phù hợp với độ chính xác của thể tích cần phân phối. Đặc biệt, độ chính xác yêu cầu đối với các thể tích chất pha loãng dùng để pha loãng thập phân là ± 2%.
4.14.3 Bảo dưỡng và kiểm tra.
Bảo quản các dụng cụ này trong điều kiện thật tốt phù hợp với hướng dẫn của nhà sản xuất.
Kiểm tra thường xuyên các lượng thể tích được phân phối.
4.15 Máy khuấy cơ học
Máy khuấy này cho phép trộn đồng nhất các môi trường lỏng khác nhau (thí dụ, dịch pha loãng thập phân và mẫu thử dạng lỏng) hoặc huyền phù của các tế bào vi sinh vật trong chất lỏng, dựa trên nguyên lý làm cho chất đựng trong ống nghiệm chuyển động xoay tròn lệch tâm (Vortex).
4.16 Thiết bị đếm khuẩn lạc
Thiết bị này tốt nhất là nên gắn với 1 hệ thống chiếu sáng trên nền màu tối, 1 kính núp với độ khuếch đại tối thiểu là 1,5 lần, và dụng cụ đếm cơ học hoặc điện tử. Có thể dùng bất kỳ hệ thống đếm tự động nào có tính năng tương đương (thí dụ máy đếm lade).
4.17 Thiết bị nuôi trong điều kiện không khí biến đổi
4.17.1 Mô tả
Đó là bình có thể gắn kín hoặc bất kỳ thiết bị nào khác có thể tạo ra các điều kiện không cải biến (thí dụ, dạng sinh trưởng hiếm khí) được duy trì trong suốt thời gian nuôi ấm của môi trường cấy. Có thể dùng các hệ thống khác với tính năng tương đương, thí dụ buông hiếm khí. Tuân thủ các hướng dẫn của nhà sản xuất trong việc lắp đặt và bảo dưỡng.
4.17.2 Tính năng sử dụng
Thành phần của môi trường khí thu được bằng 1 hỗn hợp khí (thí dụ từ bom khí) hoặc bằng bất kỳ cách khác phù hợp (chẳng hạn, gói tạo khí bán sẵn) sẽ được qui định trong tiêu chuẩn riêng.
4.17.3 Bảo dưỡng và kiểm tra
Cần phải đặt dụng cụ chỉ báo bản chất của môi trường khí trong từng buồng mỗi khi sử dụng.
Nếu có chất xúc tác, cần phải thường xuyên phụ hồi theo hướng dẫn của nhà sản xuất.
Thiết bị này phải thường xuyên được làm sạch và sát trùng.
4.18 Các trang thiết bị khác
Các
trang thiết bị và dụng cụ khác để dùng hàng ngày, bao gồm các loại sau: thiết
bị lọc, đồ chứa bằng thủy tinh hoặc chất chất dẻo (các ống nghiệm, bình cầu,
chai lọ), đĩa Petri bằng thủy tinh hoặc chất dẻo, (thường hay dùng loại có
đường kính từ 90 mm đến 100 mm), các pipet bằng thủy tinh hay bằng nhựa (loại
10 ml, 2 ml, 1 ml), dụng cụ lấy mẫu, vòng và kim cấy (bằng hợp kim niken/crom,
platin/iridi, hoặc bằng nhựa sử dụng một lần).
5 Nhân sự
5.4 Năng lực
Tất cả các nhân viên làm việc trong phòng thí nghiệm vi sinh phải được đào tạo đủ kiển thức để họ có thể thực hiện đúng các thao tác được giao.
Người thực hiện thử nghiệm cần phải có kiến thức tốt và có đủ kinh nghiệm thực tế về các kỹ thuật vi sinh và vi sinh vật. Người đó có thể thực hiện chính xác và đảm bảo các yêu cầu để thu được các kết quả có thể chấp nhận. Đối với mục đích này, họ có thể, thí dụ như tham gia vào các thử nghiệm, thành thạo sử dụng vật chuẩn, hoặc các phép thử tự đánh giá về định lượng vi sinh vật (đặc biệt cần xem các ấn phẩm có liên quan của Hiệp hội Sữa Quốc tế).
Tất cả các nhân viên phải được nhận các thông tin liên quan mới nhất về các vấn đề vệ sinh và an toàn phòng thí nghiệm.
5.2 Vệ sinh
Về lĩnh vực vệ sinh cho người, phải tuân thủ các lưu ý sau đây để tránh làm nhiễm bẩn mẫu thử và môi trường nuôi cấy, đồng thời cũng để tránh nguy cơ lây nhiễm sang con người:
- mặc áo thí nghiệm sáng màu, sạch và trong trạng thái tốt, được sản xuất từ loại sợi hạn chế được nguy cơ bắt cháy; không mặc áo choàng ra khỏi khu vực làm việc và phòng gửi áo quần;
- mang trang bị bảo vệ tóc và râu, nếu cần;
- giữ móng tay thật sạch và ăn mặc chỉnh tề, và tốt nhất nên ăn mặc gọn gàng;
- rửa tay sạch tay bằng nước ấm, tốt hơn nên rửa dưới vòi không điều khiển bằng tay, sử dụng xà phòng nước hoặc xà phòng bột, hoặc nếu có thể bằng nước rửa sát trùng cấp từ dụng cụ phân phối ở trạng thái sạch sẽ, trước và sau khi kiểm tra vi sinh vật và ngay sau khi đi vệ sinh; lau khô tay bằng giấy hoặc bằng khăn tay sử dụng một lần.
- khi đang cấy, tránh không nói chuyện, ho v.v...
- không hút thuốc, ăn uống trong các khu vực thử nghiệm;
- cần đặc biệt lưu ý người bị nhiễm trùng (u nhọt, sưng lấy ở đầu móng tay) hoặc các bệnh mà mầm bệnh có thể gây nhiễm tới mẫu thử và có thể làm hỏng kết quả thử.
- không để thức ăn của nhân viên trong các tủ lạnh đựng đồ thí nghiệm.
6 Chuẩn bị thiết bị, dụng cụ
6.1 Chuẩn bị
Thiết bị, dụng cụ để sử dụng trong vi sinh phải đảm bảo được độ sạch và / hoặc vô trùng cho đến khi sử dụng.
Trước khi dùng phải rửa sạch thiết bị, dụng cụ, ngay cả khi mới mua.
Đậy nút các ống nghiệm và chai lọ trước khi khử trùng bằng các phương tiện thích hợp (bông nén, kim loại, chất dẻo ...).
Làm nút pipet bằng bông nén hoặc các bằng chất liệu khác thích hợp.
Nếu cần, dụng cụ cần khử trùng phải được đặt trong các hộp chuyên dụng hoặc được gói trong chất liệu thích hợp (giấy chuyên dụng, giấy nhôm ...). Dụng cụ cần hấp phải rỗng (không có môi trường hoặc các chất lỏng khác) phải cho phép luồng hơi nước xuyên qua được, nếu không, việc khử trùng sẽ không có hiệu quả.
6.2 Khử trùng
6.2.1 Khử trùng bằng nhiệt khô
Đốt nóng trong tủ khử trùng (4.10) ít nhất 1 h ở nhiệt độ 170oC đến 180oC.
6.2.2 Khử trùng bằng nhiệt ẩm
Đốt nóng trong nồi hấp áp lực (4.5) ít nhất là 15 phút ở nhiệt độ tối thiểu là 121oC, tốt hơn nên được gắn với 1 thiết bị sấy chân không. Cần có hiển thị nhiệt để chắc chắn là nhiệt độ đã đạt được theo yêu cầu (thí dụ như các loại giấy đo nhiệt đặc biệt).
6.3 Dụng cụ sử dụng một lần
Dụng cụ sử dụng một lần có thể được dùng thay cho dụng cụ thủy tinh tái sử dụng (đĩa Petri, pipet, chai lọ, ống nghiêm ...) nếu có chất lượng tương đương.
Khi đó nên khẳng định bằng cách hỏi nhà sản xuất xem dụng cụ đó có thực sự thích hợp để dùng cho mục đích vi sinh vật không (đặc biệt là tính vô trùng) và rằng nguyên liệu đó không chứa các chất ức chế sự phát triển vi sinh vật.
Dụng cụ sử dụng một lần cần được khử nhiễm trước khi loại bỏ chúng. Bên cạnh các phương pháp mô tả trong điều 6.6, có thể thiêu đốt. Nếu trong cơ sở thử nghiệm có sẵn 1 lò thiêu đốt, việc khử nhiễm và loại bỏ có thể thực hiện được dễ dàng và là 1 thao tác độc lập.
6.4 Quản lý dụng cụ sạch
Trong suốt quá trình bảo quản, dụng cụ sạch phải được bảo vệ tránh bụi, đảm bảo được độ sạch.
6.5 Quản lý dụng cụ vô trùng
Trước khi sử dụng, thiết bị, dụng cụ phải được bảo quản trong các điều kiện giữ được độ vô trùng. Dụng cụ sử dụng một lần phải được bảo quản theo hướng dẫn của nhà sản xuất, không được làm hỏng bao bì; dụng cụ chuẩn bị thí nghiệm phải được bảo quản trong các vật chứa sạch.
Khi khử trùng các dụng cụ cho vi sinh, thời hạn sử dụng (hoặc ngày sản xuất) phải ghi ngay trên mỗi bao bì. Dụng cụ đựng trong bao bì gắn kín có thể bảo quản được 3 tháng đến khi sử dụng. Dụng cụ được đóng gói không kín phải bảo quản trong khoảng thời gian ngắn hơn (thí dụ: 8 ngày).
6.6 Khử nhiễm
Sau khi sử dụng (tiếp xúc với môi trường đã cấy hoặc tiếp xúc với các vi sinh vật) các dụng cụ và chất chứa bên trong phải được khử nhiễm vi sinh trước khi rửa hoặc loại bỏ. Thí dụ, nút bông chỉ được tháo ra khỏi pipet sau khi pipet đã được khử nhiễm; các ống đựng môi trường lỏng phải được khử nhiễm trước khi rửa. Việc khử nhiễm có thể tiến hành theo một trong hai cách sau đây:
- khử trùng bằng nhiệt ẩm trong nồi hấp áp lực (4.5) tất cả các dụng cụ đã tiếp xúc với mẫu cấy vi sinh vật (nuôi ấm, môi trường nuôi cấy đặc hoặc lỏng, thuốc thử bị nhiễm bẩn, ... ) ít nhất 30 phút ở nhiệt độ tối thiểu là 121oC.
- khử nhiễm bằng cách ngâm trong dung dịch chất sát trùng đối với các dụng cụ có kích thước nhỏ, không bị ăn mòn (thí dụ như pipet).
Pipet Pasteur chỉ sử dụng một lần.
Dụng cụ bằng chất dẻo có thể đốt trực tiếp, nếu luật Nhà nước cho phép.
6.7 Rửa
Chỉ rửa dụng cụ sau khi đã khử nhiễm.
Lấy ra hết các chất chứa bên trong các dụng cụ chứa.
Trước khi rửa, loại bỏ chất gắn kín khỏi nút hoặc nắp bằng cách thích hợp.
Rửa cẩn thận các nút hoặc các nắp và dụng cụ
thủy tinh trong nước nóng có dung dịch chất tẩy rửa. Nếu chất tẩy rửa không có
bán sẵn, có thể dùng dung dịch natri cacbonat 0,125% (m/m) sau đó ngâm trong
axit loãng (thí dụ, axit clohidric (HCl) ![]() =
0,1 mol/l).
=
0,1 mol/l).
Tráng tất cả các dụng cụ trong nước cất và có chất lượng tương đương.
Có thể sử dụng các dụng cụ đặc biệt để rửa (thí dụ: máy chuyên rửa pipet, máy rửa đĩa, ...).
7 Chuẩn bị, khử trùng môi trường nuôi cấy và thuốc thử
Việc chuẩn bị chính xác môi trường nuôi cấy là một trong các bước cơ bản trong phân tích vi sinh vật, do vậy cần đặc biệt thận trọng.
7.1 Nước cất
Sử dụng nước cất hoặc nước có chất lượng tương đương; nghĩa là nước không chứa các chất ức chế hoặc ảnh hưởng đến sự phát triển của vi sinh vật trong các điều kiện thử. Nếu chuẩn bị nước cất từ nước đã xử lý bằng clo, thì trung hòa clo trước khi chưng cất.
Bảo quản nước cất trong các thùng chứa làm bằng nguyên liệu trơ (thí dụ như thủy tinh trung tính, polyetylen,...) không chứa bất kỳ chất ức chế nào trước khi sử dụng.
Chú thích - Trong một vài trường hợp, cần sử dụng nước mới chuẩn bị và không chứa cacbon dioxit hòa tan.
Để được coi là chất lượng tốt, nước cất phải có điện trở suất nhỏ nhất là 300 000 Wcm.
Chú thích - Do việc chảy qua chất trao đổi ion, nước đã khử khoáng thường chứa lượng vi sinh vật cao; do đó, không nên áp dụng phương pháp này khi chưa khẳng định được là có ít lượng vi sinh vật trong nước. Tham khảo ý kiến với nhà sản xuất để có biện pháp làm giảm nhiễm vi sinh vật. Sau khi lọc khử trùng, nước đã khử ion hóa đã nhiễm vi khuẩn nhiều có thể vẫn còn chứa các chất ức chế sự phát triển của một số vi sinh vật.
7.2 Chuẩn bị môi trường nuôi cấy
Có hai cách chuẩn bị là:
- từ các thành phần cơ bản, khô hoặc không; hoặc
- từ môi trường hoàn chỉnh khô.
Các chai, lọ chứa các thành phần cơ bản khô hoặc môi trường hoàn chỉnh khô được giữ gìn, bảo vệ khỏi ánh sáng, nơi khô ráo ở nhiệt độ qui định của nhà sản xuất.
Không sử dụng sản phẩm quá hạn dùng đã ghi.
Do các thành phần khô và môi trường có tính hút ẩm, do vậy cần đóng gói chặt ngay và cẩn thận nút chai sau khi lấy mẫu. Không được dùng môi trường đã có dấu hiệu vón cục hóa cứng chứng tỏ đã hấp thụ nước.
7.2.1 Hồi nước cho sản phẩm
Làm theo hướng dẫn của nhà sản xuất.
7.2.2 Đo pH
Dùng pH mét (4.4) đo pH và điều chỉnh, nếu thấy cần, pH của môi trường sau khi khử trùng và làm nguội đến 25oC như yêu cầu ± 0,2 đơn vị pH, trừ khi có qui định khác.
Việc điều chỉnh thông thường được thực hiện bằng cách sử dụng natri hidroxit (NaOH) dung dịch khoảng 40 g/l (1 mol/l) hoặc axit clohidric khoảng 36,5 g/l (1 mol/l).
7.2.3 Phân phối
Phân phối môi trường vào các vật chứa thích hợp, hoặc thao tác bằng tay, hoặc bằng thiết bị tự động (4.14).
Dụng vật chứa có dung tích bằng thể tích của lượng được phân phối, lớn gấp hai lần hoặc ba lần thể tích đó để tránh môi trường sôi tràn quá trình hấp áp lực.
7.3 Khử trùng
Khử trùng môi trường nuôi cấy và thuốc thử có thể tiến hành các kỹ thuật khác nhau gồm:
- khử trùng bằng nhiệt ẩm;
- khử trùng bằng lọc.
Tuy nhiên, có một vài trường và thuốc thử nhất định có thể sử dụng không cần qua bất kỳ thủ tục khử trùng nào (xem tiêu chuẩn quốc tế hoặc theo qui định nhà sản xuất).
Sau khi khử trùng, môi trường phải được kiểm soát, đặc biệt là pH, màu sắc độ vô trùng và đặc tính về mặt vi khuẩn học.
7.3.1 Khử trùng bằng nhiệt ẩm
Tiến hành khử trùng bằng nhiệt ẩm trong nồi hấp áp lực độc lập (4.5) hoặc trong thiết bị chuẩn bị môi trường và bộ phận phân phối. Thông thường, quá trình hấp kéo dài khoảng 15 phút ở nhiệt độ 121oC (245 kPa). Đối với các thể tích lớn hơn 1 lít, cần theo một chu kỳ khử trùng cần thiết. Trong mọi trường hợp, phải tuân thủ các hướng dẫn của tiêu chuẩn này hay của nhà sản xuất.
Trước khi hấp khử trùng, một số vật chứa đại diện cho mỗi vị trí của nồi hấp phải được gắn với một giải giấy thử (loại có bán sẵn trên thị trường) báo nhiệt độ đạt được.
7.3.2 Khử trùng bằng lọc
Có thể tiến hành trong các điều kiện chân không hoặc tăng áp.
Dụng màng và đế lọc có đường kính lỗ 0,22 mm. Chúng đã được khử trùng trong nồi hấp áp lực (4.5) trước khi sử dụng. Tham khảo hướng dẫn của các nhà sản xuất về việc sử dụng các yếu tố lọc hoặc màng lọc được bán ở dạng vô trùng sẵn.
Khử trùng các linh kiện khác nhau đã lắp ráp hoặc chưa lắp của thiết bị lọc trong nồi hấp áp lực (4.5) 15 phút ở nhiệt độ 121oC. Nếu cần, việc lắp ráp vô trùng có thể được thực hiện trong buồng an toàn sau khi hấp áp lực. Một vài thiết bị lắp ráp sẵn có thể được bán ở dạng vô trùng.
7.4 Bảo quản
Mỗi bao gói đựng chai lọ, ống nghiệm và đĩa Petri phải được ghi nhãn và chi tiết như sau:
- tên môi trường;
- ngày chuẩn bị và/hoặc hạn dùng.
7.4.1 Môi trường nuôi cấy pha sẵn và thuốc thử
Môi trường nuôi cấy được phân và các ống nghiệm hoặc chai lọ và thuốc thử khi chưa sử dụng ngay thì phải bảo vệ tránh ánh sáng và giữ khô ráo (thí dụ như dùng nút cao su trong khi bảo quản hoặc dùng nắp xoáy).
Nếu như không có qui định nào khác, phải để môi trường nuôi cấy và thuốc thử trong tủ lạnh (4.7) với thời gian tối đa là 3 tháng, nếu để ở nhiệt độ từ 18oC đến 23oC thì thời gian tối đa là 1 tháng trong điều kiện các thành phần của chúng không bị thay đổi.
Không bao giờ sử dụng môi trường đã bị mất nước.
Trước khi sử dụng, nên để nhiệt độ của môi trường nuôi cấy cân bằng với nhiệt độ của phòng thí nghiệm.
7.4.2 Môi trường và thuốc thử sẵn sàng cho sử dụng
Cần phải tuân thủ các hướng dẫn của nhà sản xuất: thời gian sử dụng, nhiệt độ bảo quản và các điều kiện bảo quản, điều kiện sử dụng (thí dụ pH) và kiểm tra tính hiệu quả.
7.5 Làm tan chảy môi trường thạch nuôi cấy
Làm tan chảy môi trường nuôi cấy trong nồi cách thủy hoặc bằng các phương pháp khác cho kết quả tương tự (thí dụ nồi hấp hoặc lò vi sóng). Tránh đun nóng quá và khi môi trường tan phải bỏ ra ngay. Giữ môi trường nuôi cấy ở dạng tan chảy trong bể điều nhiệt duy trì nhiệt độ ở 47oC ± 2oC (4.9) cho đến khi sử dụng.
Không khi nào được dùng môi trường nuôi cấy ở nhiệt độ lớn hơn 50oC. Không nên giữ môi trường đã tan chảy quá 8h. Không sử dụng môi trường đun đi đun lại nhiều lần.
Trong trường hợp môi trường nuôi cấy đặc biệt mẫn cảm thời gian làm tan chảy phải ngắn, và được qui định trong tiêu chuẩn có liên quan.
7.6 Đuổi không khí trong môi trường nuôi cấy
Nếu cần, ngay trước khi sử dụng , đun nóng môi trường nuôi cấy trong nước sôi hoặc dưới luồng hơi nước nóng trong 15 phút, nút và nắp phải được nới lỏng, sau khi đun nóng đậy chặt nắp và làm nguội nhanh đến nhiệt độ làm việc.
7.7 Chuẩn bị đĩa Petri
Rót môi trường nuôi cấy thạch tan chảy vào các đĩa Petri thành lớp dày ít nhất là 2 mm (thí dụ, đối với đĩa có đường kính 90 mm, thông thường cần 12 ml thạch). Để cho thạch nguội và đông lại bằng cách đặt đĩa lên mặt phẳng nằm ngang, mát.
Sử dụng ngay các đĩa Petri đã chuẩn bị này hoặc bảo quản trong tủ lạnh (4.7), chỗ tối, không quá 1 tuần ở các điều kiện thành phần không bị thay đổi. Trong một vài trường hợp, thời gian này có thể kéo dài hơn hoặc ngắn và được qui định trong tiêu chuẩn liên quan. Nhãn của đĩa Petri theo 7.4.
Sử dụng các đĩa Petri khi đã được làm khô.
Nhìn chung, để cấy lên bề mặt môi trường thạch nuôi cấy, làm khô các đĩa, tốt nhất là mở nắp đĩa đã có thạch và úp mặt đĩa xuống dưới, đặt vào tủ sấy để ở nhiệt độ 25oC đến 50oC, cho đến khi các giọt nước nhỏ biến mất khỏi bề mặt môi trường. Không làm khô môi trường thêm nữa. Đĩa thạch cũng có thể được làm khô trong tủ an toàn laminar-flow trong 30 phút khi đậy nắp một nửa, hoặc để qua đêm khi nắp vẫn đậy kín.
Các đĩa thạch chuẩn bị sẵn có bán trên thị trường: Bảo quản và sử dụng theo hướng dẫn của nhà sản xuất.
8 Mẫu thí nghiệm
8.1 Lấy mẫu
Điều quan trọng mẫu phải đúng là mẫu đại diện của sản phẩm và không bị hư hỏng hoặc bị thay đổi trong suốt quá trình vận chuyển và bảo quản.
Lấy mẫu không phải là một phần của tiêu chuẩn này. Xem tiêu chuẩn riêng đối với sản phẩm liên quan. Nếu không có tiêu chuẩn riêng thì lấy mẫu theo sự thỏa thuận của các bên liên quan.
8.2 Vận chuyển
Việc vận chuyển mẫu tới phòng thí nghiệm phải đảm bảo giữ được mẫu không bị biến đổi do sự có mặt các vi sinh vật. Tốt nhất là nên vận chuyển mẫu tới phòng thí nghiệm bằng phương pháp nhanh nhất.
Đặc biệt chú ý đến nhiệt độ bảo quản của các sản phẩm sau đây:
- sản phẩm "bền": nhiệt độ phòng;
- sản phẩm tươi và sản phẩm được giữ lạnh: từ 0oC đến +4oC;
- sản phẩm đông lạnh và cực lạnh: dưới -18oC;
- sản phẩm tiệt trùng và sản phẩm tương tự: từ 0oC đến +4oC;
- sản phẩm "bền" đã hỏng: từ 0oC đến +4oC.
Cảnh báo - Các thực phẩm dễ bị ôi hỏng (thí dụ như nội tạng, cá tươi) phải bảo quản ở nhiệt độ từ 0oC đến +2oC.
Các mẫu "bền" đã hỏng phải được vận chuyển trong bao bì kín để tránh rò rỉ.
8.3 Tiếp nhận và bảo quản
Nhân viên phòng thí nghiệm phải kiểm tra trạng thái của mẫu khi tiếp nhận. Nếu trạng thái không đảm bảo hoặc nếu mẫu không đủ, thông thường phòng thí nghiệm không được nhận mẫu đó. Trong trường hợp đặc biệt, nhân viên phòng thử nghiệm có thể phân tích chúng nhưng phải lưu giữ báo cáo về tính chất hợp lệ của kết quả.
Mẫu được nhận vào phòng thí nghiệm phải được ghi chép đầy đủ sao cho có thể kiểm soát được suốt quá trình cho đến khi viết báo cáo thử nghiệm.
Các thông tin sau cần phải ghi:
- ngày nhận mẫu;
- các điểm đặc biệt khi lấy mẫu (ngày lấy mẫu, các điều kiện lấy mẫu v.v);
- tên và địa chỉ của bên yêu cầu;
- đặc trưng của sản phẩm.
Mẫu chờ kiểm tra phải bảo quản ở các điều kiện không làm thay đổi số lượng vi sinh vật có trong mẫu. Đặc biệt chú ý đến nhiệt độ bảo quản (xem 8.2) và việc kiểm tra hạn cuối của các sản phẩm sau đây:
- sản phẩm bền: càng sớm càng tốt và trước khi hết thời hạn bảo quản;
- sản phẩm tươi và sản phẩm giữ lạnh: trong vòng 24h sau khi tiếp nhận (nếu cần bảo quản mẫu lâu hơn, cần làm lạnh sâu mẫu càng sớm càng tốt ở nhiệt độ dưới -18oC và ghi vào trong báo cáo kết quả, vì ở một vài sản phẩm nhất định việc làm lạnh thay đổi thành phần của hệ sinh vật);
- sản phẩm tiệt trùng và sản phẩm tương tự: càng sớm càng tốt khi hết hạn bảo quản;
- các mẫu sản phẩm bền đã bị hỏng: càng sớm càng tốt và trước 48h.
8.4 Phần mẫu thử
Để tránh có tạp nhiễm giữa môi trường và phần mẫu thử, nên tiến hành công việc trong phòng thử nghiệm đặc biệt, hoặc trong buồng an toàn. Nếu không làm được điều đó, các sản phẩm biết trước là có rất ít vi sinh vật (thí dụ, sản phẩm tiệt trùng, món ăn đã nấu) bao giờ cũng kiểm tra trước tiên, tiếp theo mới kiểm tra mẫu bị nhiễm cao hơn.
Việc bảo vệ môi trường khỏi bị tạp nhiễm là đặc biệt quan trọng trong quá trình cân và lấy phần mẫu thử từ các sản phẩm dạng bột bị nhiễm cao. Các bước tiến hành này phải thực hiện trong tủ an toàn.
Xử lý mẫu sao cho tránh được bất kỳ nguy cơ lây nhiễm nào. Để đạt được điều đó, phải chú ý như sau:
- Khi không làm việc trong tủ an toàn, tiến hành công việc trong tầm của ngọn lửa;
- đối với sản phẩm bao gói sẵn, lau sạch bên ngoài bao bì bằng etanola 70% tại vị trí sẽ mở; nếu có thể, thì đốt bằng ngọn lửa;
- dụng cụ dùng để mở bao gói (cái mở hộp, kéo ...) phải vô trùng;
- dụng cụ để lấy mẫu (thìa, kẹp, pipet,...) phải vô trùng;
- đánh dấu cẩn thận số ký hiệu của mẫu thử trên vật chứa, túi chất dẻo (xem 83) chứa mẫu thử.
8.5 Lưu giữ và hủy mẫu thí nghiệm
Ngoại trừ đối với các trường hợp đặc biệt, lưu giữ các mẫu thí nghiệm cho đến khi thu được tất cả các kết quả, hoặc lâu hơn nữa nếu thấy cần, và bao gói trong vật đựng vô trùng (thí dụ như túi chất dẻo) và giữ ở nhiệt độ bảo quản của mẫu thử. Các sản phẩm lạnh, tươi nên làm đông lạnh.
Trước khi loại bỏ, khử nhiễm các mẫu thí nghiệm đã lỏng hoặc là mẫu nguy hiểm.
Còn các mẫu thí nghiệm không bị hỏng thì có thể loại bỏ trực tiếp.
9 Kỹ thuật kiểm tra và biểu thị kết quả
9.1 Các biện pháp để phòng về mặt vệ sinh trong quá trình kiểm tra
Chú ý tiến hành công việc trong các điều kiện vô trùng, thí dụ như:
- đảm bảo rằng khu vực làm việc sạch và không có gió lùa (cửa chính và cửa sổ phải đóng lại);
- trước và sau khi làm việc, khử nhiễm bề mặt thao tác bằng chất sát trùng thích hợp;
- đảm bảo rằng trước khi bắt đầu tiến hành công việc tất cả các thứ cần thiết đã được chuẩn bị sẵn;
- trong trường hợp tiến hành trong tủ an toàn, dùng găng tay vô trùng hoặc sát trùng tay, trước khi bắt đầu công việc (thí dụ bằng hỗn hợp polyalcohol) và tránh thao tác chéo, chạm bàn tay với cánh tay;
- khi không làm việc trong tủ an toàn, mở ống nghiệm và chai trong vùng ngọn lửa, giữ ống và chai ở vị trí nghiêng với khả năng có thể;
- thực hiện công việc càng nhanh càng tốt, và không có bất kỳ động tác thừa nào;
- đóng chặt ngay bao bì đựng pipet, đĩa Petri v.v... sử dụng một lần, sau khi lấy ra số lượng cần dùng cho việc kiểm tra.
- khử trùng vòng và kim cấy, v.v... trong ngọn lửa trước và sau khi sử dụng; để tránh phát tán các chất và các vi sinh vật, tốt nhất là dùng buồng đốt (4.13); nếu có thể, dùng vòng và kim cấy vô trùng sử dụng một lần;
- cho pipet, dao trộn, v.v... đã sử dụng vào bình có chứa 1 chất sát trùng thích hợp (thí dụ: dung dịch natri hypoclorit đối với pipet) trước khi tiến hành khử nhiễm (6.6);
- cho các dụng cụ sử dụng một lần vào các vật chứa phù hợp trước khi khử nhiễm hoặc thiếu (6.6);
- ngay lập tức lau, thấm hết các vết nhiễm bẩn hoặc bị tràn ra bằng cách dùng miếng bông gạc, hoặc vật liệu thích hợp khác đã tẩm dung dịch etanola 70% (V/V) hoặc 1 chất sát trùng khác, sau đó rửa sạch và khử trùng mặt bàn thao tác trước khi tiếp tục công việc.
Cần phải chú ý đặc biệt khi làm việc với các sản phẩm có chứa vi khuẩn gây nhiễm bệnh (Saimonella, Listeria monocytogens...) hoặc với các chất độc hại, được liệt kê trong các ấn phẩm riêng. Khuyến cáo rằng:
- sử dụng tủ an toàn cho tất cả các thao tác cần thiết để phân tích;
- sử dụng dụng cụ hút cơ học; cấm dùng pipet hút bằng miệng;
Khí sol là 1 nguyên nhân chính gây ra ô nhiễm môi trường và lây nhiễm. Khí sol có thể tạo thành do:
- khi mở các đĩa Petri, ống nghiệm và chai lọ;
- khi dùng máy lắc, xi lanh, máy ly tâm ...;
- khi làm sạch pipet bằng cách thổi;
- khi khử trùng ướt các vòng và kim cấy;
- khi mở ống hàn kín đựng chất cấy đông khô;
Do đó, cần tránh sự tạo khí sol này.
9.2 Chuẩn bị huyền phù ban đầu và các dung dịch pha loãng
Xem ISO 6887.
Trong trường hợp chuẩn bị huyền phù ban đầu, thời gian từ khi kết thúc việc chuẩn bị đến khi cấy vào môi trường nuôi cấy không được vượt quá 45 phút, trừ khi có qui định riêng trong tiêu chuẩn tương ứng.
9.3 Đếm số lượng sử dụng môi trường đặc
9.3.1 Cấy trong thạch đổ đĩa
Chuẩn bị môi trường (bằng cách đặt trên nồi cách thủy để ở 47oC, đĩa Petri, chất lỏng pha loãng và các dung dịch pha loãng cần kiểm tra (phù hợp với 9.2) theo các lượng và các đơn vị tương ứng với phương án cấy được qui định trong tiêu chuẩn có liên quan.
Phân phối các thể tích xác định từ các dung dịch pha loãng cần kiểm tra vào các đĩa Petri (có ghi nhãn). Rót vào mỗi đĩa một lượng môi trường theo qui định trong 7.7. Trộn ngay môi trường tan chảy và chất cấy sao cho có được phân bố đồng nhất vi sinh vật trong môi trường. Đặt các đĩa Petri này trên mặt phẳng nằm ngang, mát để cho nguội và đông đặc lại (thời gian đóng cửa thạch không vượt quá 10 phút).
Nếu dự kiến có các khuẩn lạc mọc lan (thí dụ: Proteus spp) trong sản phẩm cần kiểm tra, hảy phủ một lớp mỏng thạch không dinh dưỡng vô trùng, hoặc môi trường thạch nhận biết sử dụng trong phân tích lên các đĩa đã đông.
9.3.2 Cấy lên bề mặt
Đưa chất cấy vào giữa đĩa Petri đã ghi nhận trên mặt môi trường thạch nuôi cấy (đã chuẩn bị theo 7.7). Dùng que gạt bằng chất dẻo hoặc bằng thủy tinh để dàn đều trên bề mặt môi trường càng nhanh càng tốt cho đến khi không còn thấy chất lỏng trên bề mặt thạch nữa.
Có thể dùng quả cầu thủy tinh để dàn đều.
Trong 1 vài trường hợp (được nêu trong tiêu chuẩn liên quan), chất cấy có thể được lắng gạn trên 1 màng lọc sau đó mới dàn đều như trên.
9.3.3 Nuôi ấm
Khi không có qui định nào khác, lật ngược ngay các đĩa đã cấy mẫu và đặt thật nhanh vào tủ ấm đã đặt nhiệt độ thích hợp. Nếu xảy ra sự mất nước nhiều (thí dụ, ở nhiệt độ 55oC hoặc lưu thông không khí mạnh), gọi các đĩa vào các túi chất dẻo không kín trước khi nuôi ấm hoặc sử dụng hệ thống có hiệu quả tương đương. Trong suốt quá trình nuôi ấm, có thể chấp nhận 1 độ biến thiên độ nuôi, thí dụ như khi đặt các đĩa Petri vào tủ hoặc lấy ra khỏi tủ ấm.
Chú ý - Trong các trường hợp nhất định, có thể làm hai đĩa cấy dự phòng bảo quản ở +2oC để so sánh với các đĩa cấy nuôi ấm khi đếm khuẩn lạc, để tránh nhầm lẫn giữa các hạt sản phẩm kiểm tra với các khuẩn lạc.
Sau khi nuôi ấm, kiểm tra ngay các đĩa nếu có thể. Mặt khác, có thể bảo quản chúng trong tủ lạnh (4.7) tối đa là 24h, nếu không có qui định nào khác.
9.3.4 Đếm khuẩn lạc
Tiếp theo giai đoạn nuôi ấm được hướng dẫn trong tiêu chuẩn riêng, tiến hành đếm khuẩn lạc trên mỗi đĩa có chứa ít hơn 300 khuẩn lạc (hoặc bất kỳ 1 số lượng nào theo qui định trong tiêu chuẩn riêng).
Chú thích - Trong một vào trường hợp, các khuẩn lạc có thể rất khó đếm (thí dụ, khi có các vi sinh vật mọc lan). Những trường hợp này sẽ được đề cập trong tiêu chuẩn riêng.
9.3.5 Biểu thị kết quả
9.3.5.1 Phương pháp tính toán: Trường hợp chung
Để kết quả có giá trị, nhìn chung, điều cần thiết là thực hiện việc đếm khuẩn lạc trên ít nhất là một đĩa có tối thiểu 15 khuẩn lạc.
Tính số vi sinh vật có mặt trong mẫu thử, N, lấy trung bình từ hai độ pha loãng kế tiếp nhau bằng công thức sau:
![]()
trong đó
![]() là tổng các khuẩn
lạc đếm được trên tất cả các đĩa được giữ lại từ 2 độ pha loãng liên tiếp, ít
nhất có một đĩa chứa 15 khuẩn lạc.
là tổng các khuẩn
lạc đếm được trên tất cả các đĩa được giữ lại từ 2 độ pha loãng liên tiếp, ít
nhất có một đĩa chứa 15 khuẩn lạc.
V là thể tích mẫu cấy trên mỗi đĩa, tính bằng mililit;
n1 là số đĩa của độ pha loãng thứ nhất được giữ lại;
n2 là số đĩa của độ pha loãng thứ hai được giữ lại;
d là hệ số pha loãng tương ứng với độ pha loãng thứ nhất.
Làm tròn số kết quả thu được đến 2 chữ số có nghĩa. Khi số cần làm nhỏ hơn 5 thì số đứng trước nó sẽ không phải thay đổi, khi số cuối cùng là 5 hoặc lớn hơn thì làm tròn số đứng ngay trước nó lên 1 đơn vị, tiếp tục cho đến khi thu được 2 chữ số có nghĩa.
Lấy kết quả là số vi sinh vật có trong 1 mililit (sản phẩm dạng lỏng) hoặc trong 1 gam (sản phẩm dạng khác), biểu thị bằng số từ 1,0 đến 9,9 nhân với 10x, trong đó x là lũy thừa tương ứng của 10.
Thí dụ:
![]() =
= ![]()
Làm tròn kết quả như hướng dẫn trên thu được 19000 hoặc 1,9 x 104 vi sinh vật trong một gam sản phẩm.
9.3.5.2 Phương pháp tính: Trường hợp tính toán sau khi xác nhận
Trong trường hợp phương pháp sử dụng đòi hỏi phải nhận dạng, 1 số lượng A được xem xác định (thông thường là 5) từ các khuẩn lạc nuôi cấy trên mỗi đĩa được giữ lại để đếm khuẩn lạc. Sau khi xác nhận, tính toán cho mỗi đĩa số lượng vi sinh vật được xác nhận, a, theo công thức sau:
a = C
trong đó
b là số khuẩn lạc phù hợp với các đặc tính xác nhận;
C là tổng số khuẩn lạc đếm được.
Làm tròn số đến số nguyên gần nhất như chỉ dẫn trong 9.3.5.1.
Tính số N, của các vi sinh vật đã xác nhận có mặt trong mẫu thử theo công thức đưa ra trong 9.3.5.1, thay åC bằng åa.
Thí dụ:
Khi đếm trực tiếp từ 1 sản phẩm dạng lỏng cho kết quả như sau:
- ở độ pha loãng thứ nhất (10-3) được giữ lại: 66 và 80 khuẩn lạc;
- ở độ pha loãng thứ hai (10-4) được giữ lại: 4 và 7 khuẩn lạc;
Đã nuôi cấy:
- đối với 66 khuẩn lạc, 8 khuẩn lạc, 6 trong đó phù hợp với chuẩn, do đó a=50.
- đối với 80 khuẩn lạc, 9 khuẩn lạc, 6 trong đó phù hợp với chuẩn, do đó a=53.
- đối với 7 khuẩn lạc, 5 khuẩn lạc, 4 trong đó phù hợp với khuẩn, do đó a=6.
- đối với 4 khuẩn lạc, tất cả 4 khuẩn lạc đã chứng minh là vi sinh vật cần tìm, do đó a=4.
![]() =
= ![]()
Số lượng vi sinh vật được tìm thấy trong mẫu thử là 5,1x104 trong một mililit.
9.3.5.3 Số lượng ước tính
9.3.5.3.1 Nếu hai đĩa mẫu thử (sản phẩm dạng lỏng, độ pha loãng bằng 0) hoặc huyền phù ban đầu (sản phẩm dạng khác) có ít hơn 15 khuẩn lạc, thì tính giá trị trung bình số học, của các khuẩn lạc đếm được trên hai đĩa.
Biểu thị kết quả như sau:
- đối với sản phẩm dạng lỏng: số lượng vi sinh vật ước tính trong mililit NE=y
- đối với các sản phẩm khác: số lượng vi sinh vật ước tính trong mililit NE=y/d
trong đó d là hệ số pha loãng của huyền phù ban đầu.
9.3.5.3.2 Nếu hai đĩa của mẫu thử (sản phẩm dạng lỏng) hoặc huyền phù ban đầu (sản phẩm dạng khác) không chứa khuẩn lạc nào, thì biểu thị kết quả như sau:
- ít hơn 1 vi sinh vật trong mililit (sản phẩm dạng lỏng)
- ít hơn 1/d vi sinh vật trong gam (sản phẩm dạng khác)
trong đó d là hệ số pha loãng của huyền phù ban đầu.
9.3.6 Giới hạn tin cậy
Để đánh giá tính hợp thức của kết quả và tránh và thể hiện quá chặt chẽ, điều cần thiết phải là xác định khoảng tin cậy đặc trưng cho phân bố thống kê các vi sinh vật trong mẫu thử.
Các sai lệch khác do chính do kỹ thuật, đặc biệt là các sai lệch có liên quan đến lỗi trong pha loãng, mức độ sai lệch này thì khác nhau giữa các phòng thí nghiệm.
9.3.6.1 Trường hợp chung
Với xác suất 95%, khoảng tin cậy d, đặc trưng cho sự phân bố vi khuẩn trong mẫu, tính theo công thức sau:

khi: B = V(n1 + 0,1n2)d
trong đó
åC là tổng các khuẩn lạc đếm được trên tất cả các đĩa được giữ lại;
n1 là số đĩa của độ pha loãng thứ nhất được giữ lại;
n2 là số đĩa của độ pha loãng thứ hai được giữ lại;
V là thể tích chất cấy trên mỗi đĩa, tính bằng mililit;
d là hệ số pha loãng tương ứng với độ pha loãng thứ nhất.
Thí dụ: các trường hợp cực trị (xem bảng 1).
Bảng 1 - Các trường hợp cực trị
|
Số khuẩn lạc đếm được |
Trung bình tính toán |
Khoảng tin cậy |
|
|
Độ pha loãng n |
Độ pha loãng n + 1 |
||
|
300 30 |
30 30 |
300 |
278 đến 324 -7% đến +8% |
|
15 15 |
1 1 |
14 |
10 đến 20 -29% đến +43% |
Thí dụ 2: Khoảng tin cậy đối với thí dụ trong 9.3.5.1
Với N = 1,9 x 104 trong 1 gam đối với 422 khuẩn lạc đếm được, khoảng tin cậy d là:

d = (191,82 + 0,87 ± 18,30) x 102
Do đó các giới hạn của khoảng tin cậy là:
d1 = 1,7 x 104 và d2 = 2,1 x 104
Trong trường hợp này, các giới hạn của khoảng tin cậy, được biểu thị bằng phần trăm và được tính toán trên các số liệu không làm tròn, là từ -9,1% đến +10,0%.
9. 3.6.2 Trường hợp sau khi xác nhận
Với xác suất 95%, khoảng tin cậy d, đặc trưng cho sự phân bố vi khuẩn trong mẫu, tính theo công thức được đưa ra trong 9.3.6.1, khi đó thay åC bằng åa.
Thí dụ: đối với trường hợp đưa ra trong 9.3.2, số N vi sinh vật được tìm thấy là 5,1 x 104 trong 1 mililit cho 113 khuẩn lạc còn lại, do đó:
![]()
d = (51,36 + 0,87 ± 9,47) x 103
Bởi vậy, các giới hạn khoảng tin cậy là:
d1 = 4,3 x 104 và d2 = 6,2 x 104
9.3.6.3 Các số đếm ước lượng
Các giới hạn tin cậy được đưa ra trong bảng A.1 và A.2 của phụ lục A.
9.4 Đếm với việc sử dụng môi trường lỏng: kỹ thuật đếm số có xác suất lớn nhất
Chú thích - Có thể dùng hai hệ thống nuôi cấy. Hệ thống thường hay được sử dụng nhất (được gọi là hệ thống "đối xứng") có cùng số lượng ống nghiệm cho mỗi độ pha loãng, tỷ lệ tích giữa hai độ pha loãng thông thường 1/10. Các hệ thống này được sử dụng đặc biệt khi chỉ cần kiểm tra giới hạn không bị vượt quá và cũng để xác định số lượng vi sinh vật có mặt. Còn có các hệ thống được gọi là hệ thống “không đối xứng” bao gồm các số lượng ống nghiệm khác nhau cho các độ pha loãng khác nhau. Chỉ các hệ thống "đối xứng" có các dung dịch pha loãng thập phân được đề cập trong tiêu chuẩn này.
9.4.1 Nuôi cấy
Nuôi cấy một số lượng bình hoặc ống nghiệm thích hợp với cùng độ pha loãng (thí dụ, ba, năm, hoặc 10 bình cầu hay ống nghiệm) tùy theo độ chính xác mong muốn của các kết quả. Theo qui luật chung, kỹ thuật được áp dụng đòi hỏi ba bình hay ống nghiệm cho một độ pha loãng.
Dùng pipet phân phối chất cấy vào các bình hay ống nghiệm tương ứng.
Dùng 1 pipet vô trùng mới cho mỗi độ pha loãng.
9.4.2 Nuôi ấm
Đặt các bình hay ống nghiệm đã cấy mẫu vào tủ ấm, hoặc tốt hơn là đặt vào nồi cách thủy kiểm soát được nhiệt độ (4.9).
9.4.3 Giải thích kết quả
9.4.3.1 Chọn độ pha loãng
Chú thích - Huyền phù ban đầu và mẫu thử dạng lỏng cũng được coi là "các dung dịch pha loãng".
Trong trường hợp chung khi ba ống nghiệm hoặc bình trên độ pha loãng đã được nuôi cấy, chọn cho mỗi mẫu cần kiểm tra ba độ pha loãng kế tiếp nhau phù hợp với 9.4.3.1.1, 9.4.3.1.2 hay 9.4.3.1.3.
9.4.3.1.1 Trường hợp 1: Có ít nhất một độ pha loãng cho ba ống nghiệm dương tính (xem bảng 2)
Chọn độ pha loãng cao nhất (nghĩa là có nồng độ mẫu thử nhỏ nhất) cho ba ống nghiệm dương tính, cũng như vậy đối với hai dung dịch pha loãng thấp hơn theo (nghĩa là nồng độ mẫu thử cao hơn 10 lần và 100 lần của dung dịch pha loãng thứ nhất đã chọn). Xem thí dụ 1 và 9.4.3.1.2.
Nếu không có đủ các độ pha loãng tiếp theo từ dung dịch pha loãng nhất cho kết quả ba ống dương tính, thì chọn ba dung dịch pha loãng nhất trong cả loạt ống thử đó (nghĩa là các dung dịch có nồng độ mẫu thử thấp nhất trong dãy) để thay thế. Xem thí dụ 2.
Bảng 2 - Mẫu các kết quả dương tính chọn lọc để tính giá trị MPN
|
Mẫu |
Số ống nghiệm dương tính thu được từ ba ống nghiệm đã cấy các lượng mẫu/ống sau đây 1) |
MPN 2) |
|
|
Sản phẩm dạng lỏng 10 ml 1 ml 10-1 ml 10-2 ml 10-3 ml Các sản phẩm khác 1g 10-1g 10-2 g 10-3 g 10-4 g |
Sản phẩm dạng lỏng ml-1 |
Sản phẩm khác g-1 |
|
|
1 |
3 3 2 1 0 |
1,5 x 101 |
1,5 x 102 |
|
2 |
3 3 3 0 - |
2,4 x 101 |
2,4 x 102 |
|
3 |
2 2 1 1 0 |
7,4 |
7,4 x 101 |
|
4 |
3 3 0 0 0 |
2,4 |
2,4 x 101 |
|
5 |
2 2 0 1 0 |
2,1 x 101 |
2,1 |
|
1) Chữ in đậm: Tổ hợp được chọn. 2) Được tính từ chỉ số MPN cho ba ống nghiệm (bảng B1). |
|||
9.4.3.1.2 Trường hợp 2: Không có độ pha loãng nào cho kết quả ba ống dương tính
Trường hợp 1 không thể áp dụng được. Chọn ba độ pha loãng nhất của dãy (các dung dịch này có hàm lượng mẫu thử thấp nhất) có ít nhất một phản ứng dương tính. Xem thí dụ 3. Xem tiếp 9.4.3.1.3.
9.4.3.1.3 Các trường hợp đặc biệt
Trong tất cả các trường hợp, khi có nhiều hơn một trong ba độ pha loãng được chọn theo 9.4.3.1.1 và 9.4.3.1.2 không cho một ống nghiệm dương tính nào, thì chọn độ pha loãng thấp nhất mà không chứa một ống nghiệm dương tính nào (dung dịch có nồng độ mẫu thử cao nhất) và hai độ pha loãng thấp hơn liền trước nó (nghĩa là nồng độ mẫu thử cao hơn 10 lần và 100 lần của độ pha loãng thứ nhất được chọn; xem mẫu 4 và mẫu 5), trừ khi các ống dương tính chỉ tìm thấy ở độ pha loãng thứ nhất chuẩn bị từ mẫu thử. Trong trường hợp cuối cùng này, nếu cần, chọn ba độ pha loãng đầu tiên để tính số có xác suất lớn nhất (MPN), ngay cả khi dãy thử này có hai độ pha loãng không cho ống dương tính nào.
9.4.3.2 Tính số có khả năng lớn nhất (MPN)
9.4.3.2.1 Kiểm tra theo số mẫu được thử bằng dãy số trong bảng B.1, xem kết quả số ống dương tính tương ứng với các độ pha loãng được chọn theo 9.4.3.1, có thể chấp nhận được trên quan điểm thống kế. Khả năng chấp nhận này phụ thuộc vào: số mẫu được kiểm tra và quyết định chấp nhận hay bác bỏ các kết quả thuộc loại 2 và 3 (xem bảng B2).
Do đó, thí dụ chỉ các kết quả loại 1 được chấp nhận, dãy 221 sẽ chỉ được tính đến nếu kiểm tra 10 mẫu từ dãy tương ứng. Mặt khác, khi các kết quả có khả năng ít hơn thuộc loại 2 cũng được chấp nhận, dãy 221 cũng được tính đến trong trường hợp chỉ kiểm tra hai, ba hoặc năm mẫu. Trong mọi trường hợp, nếu dãy 221 là kết quả thử đơn lẻ thì không thể chấp nhận.
9.4.3.2.2 Đối với mỗi dãy coi như có thể chấp nhận theo 9.4.3.2.1, chỉ số MPN sẽ thu được theo bảng B.1.
9.4.4 Biểu thị kết quả
Từ chỉ số MPN (xem 9.4.3.2) của bảng B1, xác định số có khả năng lớn nhất của vi sinh vật theo thể tích bằng công thức sau:
Cs = M Vs
trong đó
Cs là số có khả năng lớn nhất của vi sinh vật có trong thể tích Vs;
M là chỉ số MPN đọc từ bảng 2 đối với độ pha loãng cơ bản Vo;
F là số nghịch đảo của hệ số pha loãng tương ứng với độ pha loãng, nếu có, từ mẫu thử được lấy làm độ pha loãng cơ bản, sử dụng trong bảng bên (thông thường F=10, 100, v.v...);
Vs là thể tích chuẩn được chọn để biểu thị mật độ vi sinh vật;
V0 là thể tích độ pha loãng cơ bản;
Trong trường hợp khi độ pha loãng nhỏ nhất được chọn tương ứng với các ống được chuẩn bị từ môi trường nóng độ kép (10 ml chất nuôi cấy), trước hết chia chỉ số MPN cho 10.
Nếu như MPN nhỏ hơn 0,3 vi sinh vật trong 1 mililit (sản phẩm lỏng) hoặc trong 1 gam (sản phẩm khác) và nếu như qui trình này phù hợp đối với số lượng nhỏ vi sinh vật được sử dụng, thì kết quả được biểu thị như sau: ít hơn 1 vi sinh vật trong 1 ml (sản phẩm lỏng) hoặc trong 1g (sản phẩm khác).
Thí dụ:
Trong trường hợp đối với 1 sản phẩm dạng rắn, chỉ số MPN là 24, ống thứ nhất được chọn tương ứng với việc nuôi cấy 1 ml huyền phù ban đầu (F = 10), Cs trong một gam là:
Cs = 24 x 10 = 2,4 x 102
9.4.5 Giới hạn tin cậy
Các giới hạn tin cậy được đưa ra trong bảng MPN (bảng B1).
Dùng kỹ thuật MPN có thể cho các kết quả chênh lệch lớn. Do vậy, các kết quả thu được khi dùng phương pháp cần sử dụng với sự thận trọng.
9.5 Phương pháp phát hiện
Phương pháp phát hiện là phương pháp xác định sự có mặt hay không các vi sinh vật nhất định có trong một lượng qui định của sản phẩm.
9.5.1 Nguyên tắc
Nếu không có qui định thì trộn (sản phẩm thế lỏng), hoặc đồng nhất (sản phẩm dạng khác) một lượng p của sản phẩm cần thử 9 x p ml hoặc g của 1 loại canh thang chọn lọc. Sau khi nuôi ấm, tốt nhất là nuôi trong bể điều nhiệt (4.9), dàn mỏng một vòng dịch cấy thu được lên bề mặt 1 môi trường thạch chọn lọc sao cho các khuẩn lạc mọc phân tách tốt. Sau đó xác nhận 1 số khuẩn lạc thu được sau khi nuôi ấm (thông thường là 5).
Trong một số trường hợp nhất định, tốt nhất nên tiến hành tăng sinh trước trong canh thang chọn lọc, bằng cách tăng sinh trước trong 1 canh thang dinh dưỡng, sao cho các vi sinh vật khó phát triển có thể hồi phục được. Cũng vậy, thỉnh thoảng sử dụng cùng một lúc hai hoặc nhiều canh thang chọn lọc cũng như hai hoặc nhiều môi trường thạch chọc lọc.
9.5.2 Diễn giải kết quả
Nếu như vi sinh vật cần tình được phát hiện, kết quả ghi như sau:
"có mặt trong p ml (thể lỏng) hoặc trong p g (sản phẩm dạng khác) của sản phẩm cần phân tích"
Nếu như vi sinh vật cần tìm không phát hiện thấy, kết quả ghi như sau:
"không có mặt trong p ml (thể lỏng) hoặc trong p g (sản phẩm dạng khác) của sản phẩm cần phân tích"
Không khi nào được khái quát hóa cho lượng cao hơn của sản phẩm.
9.6 Kỹ thuật xác nhận cơ bản
9.6.1 Chuẩn bị giống cấy thuần khiết
9.6.1.1 Khái quát
Bắt đầu chuẩn bị 1 giống cấy thuần khiết bằng cách chọn lọc 1 khuẩn lạc trên hoặc trong môi trường thạch đã nuôi cấy với 1 dịch mẫu thử pha loãng hoặc với 1 giống vi sinh vật.
Sau đó cấy khuẩn lạc đã chọn đó lên môi trường thạch nuôi cấy không chọn lọc. Sau khi nuôi ấm, chọn lấy 1 khuẩn lạc phân lập tốt. Nếu cần, lặp lại thao tác này.
Dùng kỹ thuật nuôi cấy đĩa trong 9.6.2.1. Các phương pháp khác nhau có thể cần đến trong các trường hợp đặc biệt. Đối với các vi sinh vật kị khí, có thể tiến hành theo qui trình trong 9.6.1.2, chú ý giữ mẫu cấy ở môi trường không khí càng ít thời gian càng tốt.
9.6.1.2 Cấy trên đĩa
Lấy một lượng nhỏ trên bề mặt khuẩn lạc phân lập tốt, bằng đầu của 1 vòng que cấy vô trùng. Sau đó đem cấy lên đĩa, hoặc cấy trực tiếp các tế bào trên vòng que cấy (9.6.1.2.10, hoặc sau khi đã chuẩn bị 1 huyền phù của các tế bào (9.6.1.2.2).
9.6.1.2.1 Phương pháp trực tiếp: thí dụ
Dùng que cấy vòng, cấy các vạch sát liền nhau trên 1 vùng khoảng một phần ba bề mặt của môi trường thạch. Khử trùng và để nguội que cấy. Từ mép của vùng đã cấy, vạch một loạt các vạch khác thưa hơn vùng thứ nhất trên một nửa bề mặt còn lại chưa cấy. Lặp lại thao tác này trên phần bề mặt còn trống với các vạch trải rộng (xem hình 1).
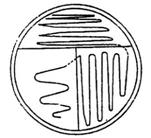
Hình 1 - Cấy trên đĩa: phương pháp trực tiếp
9.6.1.2.2 Phương pháp dùng chất lỏng pha loãng
Hòa các tế bào vào 1 ml đến 2 ml chất lỏng pha loãng chọn lọc, chà sát que cấy vòng lên bề mặt chất lỏng sát thành ống, sau đó trộn kỹ.
Khử trùng và để nguội que cấy. Dùng que cấy vòng lấy một lượng nhỏ nhũ dịch vi sinh vật và tiến hành theo 9.6.1.2.1.
9.6.1.3 Nuôi ấm
Khi không có qui định khác, lật úp các đĩa Petri đã nuôi cấy và đặt vào tủ ấm trong một thời gian và ở nhiệt độ đã chọn trước.
9.6.1.4 Chọn lọc
Sau khi nuôi ấm, chọn trên đĩa 1 khuẩn lạc phân lập tốt, hoặc để cấy truyền tiếp lên đĩa, hoặc để tiến hành xét nghiệm.
Nếu có thể, phép thử cuối cùng cần thực hiện bằng cách dùng thân các tế bào từ một khuẩn lạc riêng biệt. Nếu không đủ tế bào từ 1 khuẩn lạc, thì trước hết nên cấy truyền vào 1 môi trường lỏng hoặc môi trường thạch nghiêng, sau đó có thể tiến hành thử trên giống cấy truyền.
9.6.2 Nguộm Gram (kỹ thuật Hucker cải biến)
Việc nhuộm màu các tế bào vi khuẩn này cho phép mô tả được hình thài của vi khuẩn và phân loại chúng thành hai nhóm theo chức năng chúng có thể hay không thể giữ được màu tím của thuốc nhuộm tím tinh thể trong các điều kiện thử nghiệm.
Các kết quả phân loại này phần lớn dựa trên sự khác nhau về cấu trúc thành tế bào của hai nhóm và là điểm khác biệt chính giữa hai nhóm. Có một số cách hướng dẫn nhuộm màu Gram, nhưng tất cả phải theo các bước tuần tự dưới đây:
9.6.2.1 Dung dịch
Có thể dùng các dung dịch bán sẵn. Trong trường hợp này, phải tuân theo các chỉ dẫn của nhà sản xuất.
9.6.2.1.1 Dung dịch tím tinh thể
9.6.2.1.1.1 Thành phần
Tím tinh thể: 2,0 g
Etanola (95%): 20 ml
Amoni oxalat (C2H8N204): 0,8 g
Nước cất: 80 ml
9.6.2.1.1.2 Chuẩn bị
Hòa tan tím tinh thể trong etanola và amoni oxalat trong nước cất. Trộn hai dung dịch này và để yên hỗn hợp 24h trước khi sử dụng.
9.6.2.1.2 Dung dịch iôt
9.6.2.1.2.1 Thành phần
iốt: 1,0g
Kali iôđua (KI): 2,0g
Nước cất: 100 ml
9.6.2.1.2.2 Chuẩn bị
Hòa tan kali iôđua trong 10 ml nước cất; thêm từng phần nhỏ iôt. Sau khi hòa tan, thêm nước cho đến vạch mức 100 ml trong bình định mức.
9.6.2.1.3 Dung dịch safranin
9.6.2.1.3.1 Thành phần
Safranin O: 0,25g
Etanola (95%): 10 ml
Nước cất: 100 ml
9.6.2.1.3.2 Chuẩn bị
Hòa tan safranin trong dung dịch etanola sau đó trộn với nước cất.
9.6.2.2 Kỹ thuật nhuộm
Sau khi đã cố định trên lam kính hiển vi màng vi khuẩn được chuẩn bị từ dịch cấy có 18h đến 24h tuổi, hoặc khi canh thang đã đục, phủ lên màng này dung dịch tím tinh thể (9.6.2.1.1). Để cho phản ứng xảy ra trong 1 phút.
Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước trong vài giây.
Phủ lên lam kính dung dịch i ôt (9.6.2.1.2). Để cho phản ứng xảy ra trong 1 phút.
Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước trong vài giây.
Rót một cách nhẹ nhàng và liên tục một lớp mỏng dung dịch etanola (95%) lên lam kính để nghiêng trong khoảng thời gian không quá 30 giây cho đến khi không còn màu tím.
Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước để loại etanola.
Phủ lên lam kính bằng dung dịch safranin (9.6.2.1.3) trong 10 giây.
Tráng nhẹ lam kính để ở tư thế nghiêng bằng nước.
Làm khô lam kính.
9.6.2.3 Quan sát và nhận định
Kiểm tra lam kính dưới vật kính dầu có độ phóng đại cao của kính hiển vi (4.12). Các tế bào vi khuẩn có màu xanh lam hoặc màu tím là Gram dương (Gram +); còn có màu từ hồng thẫm đến đỏ là Gram âm (Gram -).
Đối với giống thuần khiết của 1 vài dạng vi khuẩn nhất định, có thể thu được cả hai loại tế bào Gram dương và Gram âm trong cùng 1 hiển vi trường.
Chú thích - Các tế bào vón đặc có thể cho hình ảnh không đặc trưng.
9.6.3 Phép thử catalaza
Việc phát hiện enzym này mà phân hủy hidro peroxit (H2O2) thành nước và oxi, có thể thực hiện bằng cách dùng 1 giống cấy ở canh thang, thạch nuôi cấy, hoặc một khuẩn lạc đơn lẻ trên một môi trường thạch.
Trong mọi trường hợp, khi không có qui định nào khác trong tiêu chuẩn liên quan, môi trường nuôi cấy phải không chứa máu, nếu không sau đó phải được đun nóng (môi trường máu đã được nấu).
Chú thích
1) Một vài vi khuẩn lactic có "men giả catalaza" mà không chứa bất kỳ nhóm máu nào khi chúng được nuôi cấy trong môi trường không có glucoza hoặc có một hàm lượng nhỏ (0,1%).
2) Trong trường hợp của vi khuẩn kỵ khí, mở và để trong không khí 30 giây trước khi thêm hidro peroxit.
9.6.3.1 Từ canh thang nuôi cấy
Thêm 0,5 ml dung dịch hidro peroxit 1/10 [3% (m/m)] vào 1 ml chất cấy. Quan sát sự xuất hiện các bong bóng oxi (catalaza dương tính) hoặc không có (thì đó là catalaza âm tính).
9.6.3.2 Từ giống cấy trên môi trường thạch
Phủ lên chất cấy từ 1 ml đến 2 ml dung dịch hidro peroxit 1/10. Quan sát ngay và sau 5 phút xem có hình thành hay không các bong bóng oxi.
9.6.3.3 Từ một khuẩn lạc
Nhỏ hai giọt riêng biệt dung dịch hidro pexorit 1/10 lên 1 lam kính.
Lấy ra một khuẩn lạc bằng que thủy tinh hoặc que nhựa vô trùng (đặc biệt không được dùng que kim loại) và nhẹ nhàng nhũ hóa vào trong 2 giọt. Quan sát ngay và sau vài phút (ít nhất là 1 phút) xem có hình thành hay không các bong bóng oxi. Khi còn nghi ngờ, quan sát từng giọt dưới là kính mỏng và so sánh sự xuất hiện bong bóng dưới cả hai lá kính đó.
Việc quan sát có thể thực hiện một cách vĩ mô hoặc sử dụng kính hiển vi có độ khuếch tán đại thấp.
9.6.4 Phép thử oxidaza
Phát hiện oxidaza bằng sự đổi màu của 1 hỗn hợp ở thời điểm oxi hóa dưới tác động của enzym này.
9.6.4.1 Thuốc thử
9.6.4.1.1 Thành phần
N, N, N', N'-Tetrametyl-p-phenylendiamin dihidroclorua (C10H16N2.2HCl): 1,0 g
Nước cất: 100 ml
9.6.4.1.2 Chuẩn bị
Hòa tan thuốc thử này trong nước lạnh. Chỉ sử dụng thuốc thử vừa mới chuẩn bị xong.
Có thể sử dụng đĩa hoặc que thử có bán sẵn trên thị trường. Trong trường hợp này, phải theo chỉ dẫn của nhà sản xuất.
9.6.4.2 Kỹ thuật
Làm ẩm một mảnh giấy lọc bằng thuốc thử. Lấy mẫu cấy vi khuẩn thu được từ 1 môi trường thạch bằng que cấy platin hoặc bằng que thủy tinh hoặc chất dẻo (dây bằng hợp kim niken/crôm cho dương tính không chính xác) và đặt lên giấy lọc đã làm ẩm.
9.6.4.3 Diễn giải kết quả
Trong trường hợp có oxidaza, sẽ xuất hiện màu tím đến đỏ tía trong khoảng thời gian 5 giây đến 10 giây. Nếu màu sắc không đổi sau 10 giây thì phép thử được coi là âm tính.
9.6.5 Sử dụng dãy chuẩn bị galleries sinh hóa để nhận biết
Có thể dùng galleries sinh hóa có sẵn để nhận biết. Tuy nhiên các galleries thương mại cho độ tin cậy như nhau. Do vậy, phải đánh giá tính năng sử dụng chúng trước khi dùng, đặc biệt nếu chúng không được hợp thức hóa bởi 1 hệ thống độc lập.
Phụ lục A
(qui định)
Giới hạn khoảng tin cậy đối với các số ước tính
Các giá trị cho sẵn trong bảng A.1 và A.2 được dựa trên tài liệu tham khảo số [10].
Bảng A.1 - Đếm từ một đĩa Petri
|
Số lượng vi sinh vật 1) |
Giới hạn tin cậy ở mức 95% |
Phần trăm sai số đối với giới hạn 2) |
||
|
Giới hạn dưới |
Giới hạn trên |
Giới hạn dưới |
Giới hạn trên |
|
|
1 |
<> |
6 |
-97 |
+457 |
|
2 |
<> |
7 |
-88 |
+261 |
|
3 |
<> |
9 |
-79 |
+192 |
|
4 |
1 |
10 |
-73 |
+156 |
|
5 |
2 |
12 |
-68 |
+133 |
|
6 |
2 |
13 |
-63 |
+118 |
|
7 |
3 |
14 |
-60 |
+106 |
|
8 |
3 |
16 |
-57 |
+97 |
|
9 |
4 |
17 |
-54 |
+90 |
|
10 |
5 |
18 |
-52 |
+84 |
|
11 |
6 |
20 |
-50 |
+79 |
|
12 |
6 |
21 |
-48 |
+75 |
|
13 |
7 |
22 |
-47 |
+71 |
|
14 |
8 |
324 |
-45 |
+68 |
|
15 |
8 |
25 |
-44 |
+65 |
|
1) Bằng số lượng khuẩn lạc 2) So sánh với số đếm vi sinh vật (cột thứ nhất). |
||||
Bảng A.2 - Đếm các khuẩn lạc từ hai đĩa Petri
|
Số lượng vi sinh vật 1) |
Số lượng vi sinh vật |
Giới hạn tin cậy ở mức 95%
|
Phần trăm sai số đối với giới hạn 2) |
||
|
Giới hạn dưới |
Giới hạn trên |
Giới hạn dưới |
Giới hạn trên |
||
|
1 |
1 |
<> |
3 |
-97 |
+457 |
|
2 |
1 |
<> |
4 |
-88 |
+261 |
|
3 |
2 |
<> |
4 |
-79 |
+192 |
|
4 |
2 |
1 |
5 |
-73 |
+156 |
|
5 |
2 |
1 |
6 |
-68 |
+133 |
|
6 |
3 |
1 |
6 |
-63 |
+118 |
|
7 |
4 |
2 |
7 |
-60 |
+106 |
|
8 |
4 |
2 |
8 |
-57 |
+97 |
|
9 |
4 |
2 |
9 |
-54 |
+90 |
|
10 |
5 |
2 |
9 |
-52 |
+84 |
|
11 |
6 |
3 |
10 |
-50 |
+79 |
|
12 |
6 |
3 |
10 |
-48 |
+75 |
|
13 |
6 |
3 |
11 |
-47 |
+71 |
|
14 |
7 |
4 |
12 |
-45 |
+68 |
|
15 |
8 |
4 |
12 |
-44 |
+65 |
|
16 |
8 |
5 |
13 |
-43 |
+62 |
|
17 |
8 |
5 |
14 |
-42 |
+60 |
|
18 |
9 |
5 |
14 |
-41 |
+58 |
|
19 |
10 |
6 |
15 |
-40 |
+56 |
|
20 |
10 |
6 |
15 |
-39 |
+54 |
|
21 |
10 |
6 |
16 |
-38 |
+53 |
|
22 |
11 |
7 |
17 |
-37 |
+51 |
|
23 |
12 |
7 |
17 |
-36 |
+50 |
|
24 |
12 |
8 |
18 |
-36 |
+49 |
|
25 |
12 |
8 |
18 |
-35 |
+48 |
|
26 |
13 |
8 |
19 |
-35 |
+47 |
|
27 |
14 |
9 |
20 |
-34 |
+46 |
|
28 |
14 |
9 |
20 |
-34 |
+45 |
|
29 |
14 |
9 |
21 |
-33 |
+44 |
|
30 |
15 |
10 |
21 |
-32 |
+43 |
|
1) Được đếm trên 2 đĩa Petri 2) So sánh với số đếm vi sinh vật (cột 2). |
|||||
Phụ lục B
(qui định)
Các bảng MPN
Bảng B.1 - Bảng MPN cho 3 x 1 g (ml), 3 x 0,1 g (ml) và 3 x 0,01 g (ml)
|
Số kết quả dương tính |
MPN |
Cấp hạng khi số lượng thử nghiệm là |
Giới hạn tin cậy |
|||||||||
|
1 |
2 |
3 |
5 |
10 |
>95% |
>95% |
>99% |
>99% |
||||
|
0 |
0 |
0 |
<> |
|
|
|
|
|
0,00 |
0,94 |
0,00 |
1,40 |
|
0 |
0 |
0 |
0,30 |
3 |
2 |
2 |
2 |
1 |
0,01 |
0,95 |
0,00 |
1,40 |
|
0 |
1 |
0 |
0,30 |
2 |
1 |
1 |
1 |
1 |
0,01 |
1,00 |
0,00 |
1,60 |
|
0 |
1 |
1 |
0,61 |
0 |
3 |
3 |
3 |
3 |
0,12 |
1,70 |
0,05 |
2,50 |
|
0 |
2 |
0 |
0,62 |
3 |
2 |
2 |
2 |
1 |
0,12 |
1,70 |
0,05 |
2,50 |
|
0 |
3 |
0 |
0,94 |
0 |
0 |
0 |
0 |
3 |
0,35 |
3,50 |
0,18 |
4,60 |
|
1 |
0 |
0 |
0,36 |
1 |
1 |
1 |
1 |
1 |
0,02 |
1,70 |
0,01 |
2,50 |
|
1 |
0 |
1 |
0,72 |
2 |
2 |
1 |
1 |
1 |
0,12 |
1,70 |
0,05 |
2,50 |
|
1 |
0 |
2 |
1,1 |
0 |
0 |
3 |
3 |
3 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
1 |
0 |
0,74 |
1 |
1 |
1 |
1 |
1 |
0,13 |
2,00 |
0,06 |
2,70 |
|
1 |
1 |
1 |
1,1 |
3 |
3 |
2 |
2 |
2 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
2 |
0 |
1,1 |
2 |
2 |
1 |
1 |
1 |
0,4 |
3,5 |
0,2 |
4,6 |
|
1 |
2 |
1 |
1,5 |
3 |
3 |
3 |
3 |
2 |
0,5 |
3,8 |
0,2 |
5,2 |
|
1 |
3 |
0 |
1,6 |
3 |
3 |
3 |
3 |
2 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
0 |
0 |
0,92 |
1 |
1 |
1 |
1 |
1 |
0,15 |
3,50 |
0,07 |
4,60 |
|
2 |
0 |
1 |
1,4 |
2 |
1 |
1 |
1 |
1 |
0,4 |
3,5 |
0,2 |
4,6 |
|
2 |
0 |
2 |
2,0 |
0 |
3 |
3 |
3 |
3 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
0 |
1,5 |
1 |
1 |
1 |
1 |
1 |
0,4 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
1 |
2,0 |
2 |
2 |
1 |
1 |
1 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
1 |
2,0 |
2 |
2 |
1 |
1 |
1 |
0,5 |
3,8 |
0,2 |
5,2 |
|
2 |
1 |
2 |
2,7 |
0 |
3 |
3 |
3 |
3 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
2 |
0 |
2,1 |
1 |
1 |
1 |
1 |
1 |
0,5 |
4,0 |
0,2 |
5,6 |
|
2 |
2 |
1 |
2,8 |
3 |
2 |
2 |
2 |
1 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
2 |
2 |
3,5 |
0 |
0 |
0 |
0 |
3 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
3 |
0 |
2,9 |
3 |
2 |
2 |
2 |
1 |
0,9 |
9,4 |
0,5 |
14,2 |
|
2 |
3 |
1 |
3,6 |
0 |
3 |
3 |
3 |
3 |
0,9 |
9,4 |
0,5 |
14,2 |
|
3 |
0 |
0 |
2,3 |
1 |
1 |
1 |
1 |
1 |
0,5 |
9,4 |
0,3 |
14,2 |
|
3 |
0 |
1 |
3,8 |
1 |
1 |
1 |
1 |
1 |
0,9 |
10,4 |
0,5 |
15,7 |
|
3 |
0 |
2 |
6,4 |
3 |
3 |
2 |
2 |
2 |
1,6 |
18,1 |
1,0 |
25,0 |
|
3 |
1 |
0 |
4,3 |
1 |
1 |
1 |
1 |
1 |
0,9 |
18,1 |
0,5 |
25,0 |
|
3 |
1 |
1 |
7,5 |
1 |
1 |
1 |
1 |
1 |
1,7 |
19,9 |
1,1 |
27,0 |
|
3 |
1 |
2 |
12 |
3 |
2 |
2 |
2 |
1 |
3 |
36 |
2 |
44 |
|
3 |
1 |
3 |
16 |
0 |
0 |
0 |
3 |
3 |
3 |
38 |
2 |
52 |
|
3 |
2 |
0 |
9,3 |
1 |
1 |
1 |
1 |
1 |
1,8 |
36,0 |
1,2 |
43,0 |
|
3 |
2 |
1 |
15 |
1 |
1 |
1 |
1 |
1 |
3 |
38 |
2 |
52 |
|
3 |
2 |
2 |
21 |
2 |
1 |
1 |
1 |
1 |
3 |
40 |
2 |
56 |
|
3 |
2 |
3 |
29 |
3 |
3 |
3 |
2 |
2 |
9 |
99 |
5 |
152 |
|
3 |
3 |
0 |
24 |
1 |
1 |
1 |
1 |
1 |
4 |
99 |
3 |
152 |
|
3 |
3 |
1 |
46 |
1 |
1 |
1 |
1 |
1 |
9 |
198 |
5 |
283 |
|
3 |
3 |
2 |
110 |
1 |
1 |
1 |
1 |
1 |
20 |
400 |
10 |
570 |
|
3 |
3 |
3 |
>110 |
|
|
|
|
|
|
|
|
|
|
Chú thích - Giới hạn tin cậy đưa ra trong bảng B.1 chỉ có ý định cung cấp một số khái niệm về ảnh hưởng của biến thiên thống kê trên kết quả. Luôn luôn có các nguồn biến thiên khác mà đôi lúc cũng có thể có nghĩa |
||||||||||||
Bảng B.2 - Giải thích kết quả
|
Cấp hạng |
Định nghĩa |
|
1 |
Khi số lượng vi sinh vật trong sản phẩm đúng bằng MPN tìm được, thì kết quả là một trong các số mà có khả năng cao nhất thu được. Hầu như chỉ có 5% trường hợp thu được kết quả ít xảy ra hơn xác xuất nhỏ nhất ở cấp hạng này. |
|
2 |
Khi số lượng vi sinh vật trong sản phẩm đúng bằng MPN tìm được, kết quả là một trong các số ít có khả năng hơn để thu được, ngay cả số xác suất thấp ít xảy ra nhất trong loại 1, nhưng tối đa chỉ được có 1% khả năng thu được 1 kết quả xác suất thấp hơn, mà khả năng này xác suất nhỏ nhất ở cấp hạng này. |
|
3 |
Khi số lượng vi sinh vật trong sản phẩm đúng bằng MPN tìm được, kết quả là một trong các số mà ít có khả năng thu được hơn, ngay cả số đó có thể ít xảy ra nhất trong loại 2, nhưng tối đa chỉ có 0,1% khả năng thu được của kết quả ít có thể xảy ra hơn xác suất nhỏ nhất ở cấp hạng này. |
|
4 |
Khi số lượng vi sinh vật trong sản phẩm đúng bằng MPN tìm được, kết quả là một trong các số ít có khả năng thu được hơn, ngay cả số xác suất thấp nhất trong loại 3. Chỉ có 1 khả năng 0,1% thu được 1 kết quả ở cấp hạng này mà không có bất kỳ một nhầm lẫn nào. |
Trước khi bắt đầu kiểm tra, cần quyết định xem cấp hạng nào sẽ được chấp nhận, đó là: chỉ cấp hạng 1,1 và 2 hoặc kể cả 1,2 và 3 (xem bảng B.1 và B.2). Nếu việc quyết định được dựa trên cơ sở của kết quả, thì điều quan trọng là chỉ được chấp nhận kết quả của cấp hạng 1 hoặc tối đa kết quả của cấp hạng 1 và 2. Kết quả của cấp hạng 0 cần được xem xét hết sức cẩn thận.
Phụ lục C
(tham khảo)
Thư mục
1 Tiêu chuẩn của úc AS 1766, Các phương pháp chuẩn của Úc về kiểm tra vi sinh vật trong thực phẩm - Phần 1: Kỹ thuật và qui trình chung.
2 Tiêu chuẩn của úc AS 2243, an toàn trong phòng thí nghiệm - Phần 3: Vi sinh vật học.
3 Butiaux. R., Beerens, H., và T quet, A. Manuel de techniques B teriologiques.
4 Bản tóm tắt các phương pháp kiểm tra vi sinh vật trong thực phẩm. (Speek N. L., ed). APHA intersociety/Agency Committee on Microbiological method for foods. Hiệp hội sức khỏe cộng đồng Mỹ, Washington, 1976.
5 Cruickshank et al. Vi sinh vật học trong Y học. Tập 2, edn. Churchill-Livingstone, Edinburgh, 1975.
6 Tiêu chuẩn Kenya KS 05-176-1978, Các phương pháp kiểm tra vi sinh trong thực phẩm - Phần 1: Kỹ thuật và qui trình chung.
7. Harrewijin, G.A and Hartog, B.J. Hướng dẫn thực hiện phân tích vi sinh trong thực phẩm và các sản phẩm thực phẩm ("Thực hành thí nghiệm tốt").De.Ware - Chemicus, 9, 1979, trang 1-11.
8 Mối nguy hiểm trong phòng thí nghiệm hóa học. (Muir G.D.ed). Royal of Chemistry, London, 1971.
9 Jarvis, B. Những khía cạnh thống kê của việc phân tích vi sinh vật thực phẩm. Trong: Tiến bộ trong công nghệ vi sinh. Tập 21, Elsevier, Amsterdam, 1989.
10 Johson, N.J and Kotz, S.Discrete distribution, Houghon Mifflin Company, Boston, 1969.
11 Sách hướng dẫn an toàn sinh học phòng thí nghiệm. Geneva, 1983.
12 Harrigan W.F. vaf McCance M.E. Các phương pháp phòng thí nghiệm vi sinh trong sữa và thực phẩm.ademic Press, London and New York, 1976.
13 An toàn phòng thí nghiệm ở trung tâm kiểm tra bệnh (CDC).NHEW Publication No.CDC 79-8118, Atlanta, 1979.
14 An toàn phòng thí nghiệm ở trung tâm kiểm tra bệnh. U.S.D. về y tế, giáo dục và phúc lợi (dịch vụ y tế cộng đồng) Atlanta, 1979.
15 Sách hướng dẫn các phương pháp về vi khuẩn học chung (đại cương). (Gerhart P., Murray R.G.E., Costillow. R.N.,Nester E.W., Krieg N.R và Phillips G.B. eds.). American Society for Microbiology, Washington, DC 20006, 1981.
16 Các phương pháp trong vi sinh. (NorrisJ.R. and Ribbons D.W. eds.). Vol 1, Academic pres, London and New York,.1969.
17 Hướng dẫn điều tiết phòng thí nghiệm vi sinh. National Association of Testing Authorities, Australia.
18 Vi sinh vật trong thực phẩm: 1-ý nghĩa của chúng và các phương pháp đêms. ICMSF, University of Toronto Press, 1988.
19 An toàn trong vi sinh. Society for Applide Bacteriology. Technican Series No.1 and No. 6. Shapton D.A. and Board r.g. (Hauster W.J. eds.). ademic Press, London and New York, 1972.
20 Các phương pháp chuẩn để kiểm tra các sản phẩm sữa. (Hauster W.J. eds.). 13th edn.,American Public Health Association, Washington, 1972.
21 Các bảng MPN của De Man, J.C.(đã chỉnh). Eur.J.Appl. Biotechnol.,17,1983, trang 301 - 305.