Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6662:2000 (ISO 10260 : 1992) về chất lượng nước - Đo thông số sinh hoá - Phương pháp đo phổ xác định nồng độ clorophyl-a do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6662 : 2000
ISO10260 : 1992
CHẤT
LƯỢNG NƯỚC - ĐO THÔNG SỐ SINH HOÁ - PHƯƠNG PHÁP ĐO PHỔ XÁC ĐỊNH NỒNG ĐỘ
CLOROPHYL-A
Water quality - Measurement of biochemical parameters - Spectrometric
determination of the chlorophyll-a concentration
Lời nói đầu
TCVN 6662 : 2000 hoàn toàn tương đương với ISO 10260 : 1992 . TCVN 6662 : 2000 do Ban Kỹ thuật Tiêu chuẩn TCVN/TC 147
Chất lượng nước biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
CHẤT LƯỢNG NƯỚC - ĐO THÔNG SỐ SINH HÓA - PHƯƠNG PHÁP ĐO PHỔ XÁC ĐỊNH NỒNG ĐỘ CLOROPHYL-A
Water quality - Measurement of biochemical parameters - Spectrometric determination of the chlorophyll-a concentration
1 Phạm vi áp dụng
1.1 Tiêu chuẩn này qui định phương pháp xác định nồng độ clorophyl-a. Phương pháp này có thể áp dụng cho thực vật phù du trong nước mặt tự nhiên và để thử sự tăng trưởng của tảo trong thử nghiệm sinh học. Dùng cách lấy mẫu thích hợp, phương pháp có thể áp dụng cho các thực vật đáy (phụ lục A).
1.2 Các picment tảo khác như clorophyl-b , clorophyl-c và một vài chất chuyển hoá clorophyl không được xác định. Các picment nâu (phaeopicment) có thể được xác định bán định lượng để hiệu chỉnh cản trở khi xác định clorophyl-a và để chỉ ra phần sinh khối tảo không hoạt hóa.
1.3 Clorophyl nhạy với ánh sáng và oxi, nhất là khi bị chiết. Để tránh phân hủy do oxi hóa và quang hóa, không được để mẫu ra không khí hoặc ánh sáng mạnh. Đồng nhất mẫu trong một số trường hợp có thể làm tăng hiệu suất chiết.
1.4 Phương pháp chiết bằng etanol gồm việc đun nóng 75 oC trong 5 min để ức chế men clorophylaza và để thúc đẩy sự phân giải picment. Bảo quản phần chiết (không lọc) trước khi đo phổ trong thời gian ngắn, có thể đến ba ngày trong tủ lạnh ở 4 oC. Bảo quản phần chiết dưới - 25 oC có thể đến ba mươi ngày.
1.5 Mặc dầu suốt quy trình có sử dụng lọc hoặc ly tâm để làm cho phần chiết cuối cùng trong nhưng nó vẫn có thể bị đục nhẹ. Sự axit hóa có thể cũng gây đục. Do đó độ hấp thụ đo ở 665 nm cần được hiệu chỉnh độ đục bằng cách trừ độ hấp thụ đo ở 750 nm.
1.6 Picment của một vài khuẩn ưa sáng (thí dụ Clorobium) cản trở xác định nồng độ clorophyl-a [1]. Độ hấp thụ của clorophyl-b và clorophyl-c ở 665 nm rất nhỏ, có thể bỏ qua [2].
2 Tiêu chuẩn trích dẫn
ISO 5667-1:1980, Chất lượng nước - Lấy mẫu - Phần 1: Hướng dẫn lập chương trình lấy mẫu.
TCVN 5992: 1995 (ISO 5667-2:1991), Chất lượng nước - Lấy mẫu - Hướng dẫn kĩ thuật lấy mẫu.
3 Nguyên tắc
Lấy tảo và chất lơ lửng trong mẫu nước bằng lọc. Chiết picment tảo từ phần còn lại của quá trình lọc vào etanol nóng. Đo phổ xác định nồng độ clorophyl-a trong phần chiết. Đánh giá nồng độ clorophyl-a và picment nâu từ sự khác nhau của độ hấp thụ ở 665 nm trước và sau khi axit hóa phần chiết [3] [4].
4 Thuốc thử
Chỉ dùng các thuốc thử tinh khiết phân tích và nước đã loại ion hoặc nước tinh khiết tương đương.
4.1 Axit clohydric, c(HCl) = 3 mol/l.
4.2 Etanol, (C2H5OH), dung dịch nước 90 % (V/V).
Chú thích 1 - Phần bị biến chất trong etanol không cản trở phép xác định. Tuy nhiên, nên xác định so sánh bằng etanol tinh khiết (90 %) làm nền với mỗi lô mẫu mới [4].
5 Thiết bị, dụng cụ
Các thiết bị, dụng cụ thông thường trong phòng thí nghiệm và:
5.1 Máy đo phổ, dùng ở vùng khả kiến đến 750 nm, với độ phân giải 1 nm, chiều rộng dải nhỏ hơn 2 nm, độ nhạy nhỏ hơn hoặc bằng 0,001 đơn vị độ hấp thụ, có các cuvet nằm trong khoảng 1 cm đến 5 cm.
5.2 Thiết bị lọc chân không, có giá và kẹp.
5.3 Cái lọc bằng sợi thủy tinh không có chất hữu cơ, để lọc mẫu nước và giữ lại hơn 99 % các hạt lớn hơn 1 àm. Dải đường kính cái lọc thích hợp từ 25 mm đến 50 mm.
5.4 Cái lọc phần chiết, mô tả như 5.3 nhưng đường kính nhỏ hơn, thí dụ 25 mm.
Cách khác: ly tâm, gia tốc 6 000 g và mâm quay phù hợp cho các ống nghiệm chiết.
5.5 Nồi cách thủy, điều chỉnh được ở 75 oC + 1 oC có chỗ vừa cho bình chiết.
5.6 Bình chiết, thí dụ các lọ nhỏ màu nâu, miệng rộng, có nút vặn bằng polytetrafloetylen (PTFE), dung tích từ 30 ml đến 50 ml, thích hợp cho việc ly tâm ở 6000 g.
6 Lấy mẫu và bảo quản mẫu
Lấy mẫu theo ISO 5667-1 và TCVN 5992: 1995 (ISO 5667-2). Có thể bảo quản mẫu trong tủ lạnh, không quá 8 h, nhưng nên tránh. Nếu có thể, thực hiện 7.1 đến 7.3 ngay sau khi lấy mẫu. Nếu cần, giữ phần chiết thô trong bình chiết thuỷ tinh màu nâu kín khí (5.6) ở dưới - 25 oC thì được ba mươi ngày. Không giữ lại mẫu nước đông lạnh hoặc cái lọc có chất rắn.
7 Cách tiến hành
7.1 Lọc
Lắc để trộn kỹ mẫu. Lọc một thể tích mẫu Vs (thường khoảng 0,1 đến 2 lit, phụ thuộc vào chiết tảo) qua cái lọc bằng sợi thủy tinh (5.3) gắn trên giá. Làm khô cái lọc trong chân không, và khi vừa khô thì lấy khỏi giá đỡ và đặt vào bình chiết. Nếu cái lọc không vừa bình chiết thì cắt cái lọc thành từng mảnh nhỏ.
Tránh chạm ngón tay vào mẫu.
7.2 Phương án chiết A
Đun nóng một thể tích etanol (4.2) đến 75 oC.
Rót một thể tích nhỏ etanol nóng (30 ml đến 40 ml) vào bình chứa cái lọc hoặc mảnh của nó. Để nguội vài phút, nghiền cái lọc để dễ chiết, nên dùng máy làm đồng nhất có con khuấy dạng que.
Rửa que khuấy bằng một ít etanol (4.2) để loại mảnh vụn bám vào đó. Chiết phần huyền phù trong ít nhất 3 min.
Chú thích 2 - Việc chiết thường được thực hiện ở nhiệt độ phòng nhiều giờ hoặc qua đêm. Nếu chiết kéo dài hoặc phần chiết được lưu giữ nhiều ngày (thí dụ qua cuối tuần) thì bình chiết cần để trong tủ lạnh.
Lọc dung dịch qua cái lọc dày (5.4) vào bình định mức (dung tích 50 ml hoặc 100 ml) có nút. Rửa bình chiết bằng etanol (4.2) và chuyển định lượng vào bình định mức. Định mức đến vạch, đậy kín và lắc đều. Đó là thể tích phần chiết Ve.
Làm tiếp với bước 7.4.
7.3 Phương án chiết B
Lấy chính xác một thể tích VE (20 ml hoặc 25 ml) etanol (4.2) vào bình chiết (5.6) để ngập hết cái lọc. Đóng nắp chặt để tránh phần chiết bay hơi. Lắc nhẹ để ổn định phần cặn. Đặt vào nồi cách thủy để phần chiết trong bình ngang mức với nước trong nồi. Đun 5 min, lắc nhẹ nếu cần. Lấy bình chiết ra khỏi nồi và để nguội đến nhiệt độ phòng trong 15 min.
Thời gian giữa chiết và đo phải là tối thiểu.
Chú thích 3 - Phần chiết ở giai đoạn này có thể giữ trong tủ lạnh qua đêm trước khi đo (xem 7.4). Không lưu giữ quá ba ngày.
Lọc phần trong của phần chiết qua cái lọc (5.4), hứng vào bình phản ứng sạch (5.6), bình này không được tráng bằng dung môi (xem chú thích 4).
Có thể ly tâm bình phản ứng để thu được phần trong. Dùng phần chiết trong để đo quang.
Chú thích 4 - Khi dùng phương pháp này, chỉ cần thu lấy một phần thể tích chiết vì thể tích Ve đã biết chính xác và không mất do bay hơi do đã nút kín. Ngoài ra, nước ở trong cái lọc có thể bỏ qua (xem 7.1) vì nó chỉ nhỏ hơn 5 % thể tích chiết.
7.4 Đo quang
7.4.1 Dùng pipét chuyển một phần chiết trong vào cuvet của máy đo phổ, để lại một ít đủ cho bước axit hóa (xem 7.4.2).
Đo độ hấp thụ ở 665 nm (A665) và 750 nm (A750) so với etanol (4.2).
Chú thích 5 - Độ hấp thụ ở 665 nm phải nằm trong khoảng 0,01 đến 0,8 đơn vị. Điều đó có thể đạt
được nhờ lấy phần thể tích đã lọc, thể tích chiết, pha loãng, cu vet ... phù hợp. Để bắt đầu, lấy 0,5
lit mẫu, cái lọc đường kính 50 mm, 20 ml etanol và cuvet 5 cm.
7.4.2 Axit hóa phần chiết (thường là 5 ml đến 10 ml) bằng 0,01 ml axit clohydric (4.1) cho 10 ml phần chiết, lắc và đo độ hấp thụ ở 665 nm và 750 nm sau 5 min đến 30 min.
8 Tính toán và biểu thị kết quả
8.1 Nồng độ ρc của clorophyl-a, được tính bằng microgam trên lit, theo công thức:
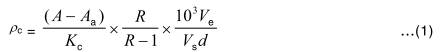
trong đó
A = A665 - A750 là độ hấp thụ của phần chiết trước khi axit hóa (xem 7.4.1);
Aa = A665 - A750 là độ hấp thụ của phần chiết sau khi axit hóa;
Ve là thể tích phần chiết, tính bằng mililit;
Vs là thể tích mẫu đã lọc, tính bằng lit;
Kc = 82 l/μg-cm là hệ số hấp thụ phổ đặc trưng cho clorophyl-a, giá trị này được lấy từ [2];
R = 1,7 là tỷ số A/Aa cho dung dịch clorophyl-a tinh khiết bị chuyển thành phaeophytin do axit hóa (xem 7.4.2) (giá trị này được lấy từ [2]);
d là chiều dài quang của cuvet, tính bằng centimet;
103 là hệ thập phân số của Ve.
8.2 Nồng độ ρp của phaeopicment, tính bằng microgam trên lit , được tính theo công thức:
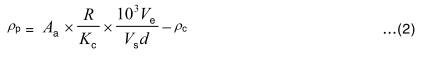
8.3 Khi giá trị 82 được lấy cho hệ số hấp thụ phổ đặc trưng của clorophyl-a trong etanol 90 %, và 1,7 được lấy cho hệ số axit cực đại (R) của clorophyl-a tinh khiết thì nồng độ clorophyl-a trong mẫu nước được đơn giản hóa thành
![]()
và nồng độ phaeopicment từ công thức (2) được đơn giản hóa thành công thức (4):
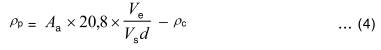
Chú thích
6 Giá trị tính toán của phaeopigment không ổn định như nồng độ clorophyl-a. Một phép thử liên phòng thí nghiệm đã chỉ rõ độ lệch 5 % đến 11 % đối với clorophyl-a và 6 % đến 46 % đối với phaeopigment.
7 Tỷ số A/Aa là 1,7 nếu chỉ có clorophyl-a tồn tại trong mẫu, và là 1 nếu sản phẩm phân hủy của clorophyl-a tồn tại trong mẫu.
Hệ số hấp thụ (82) cho clorophyl-a trong etanol (4.2) được lấy ở [5] ở 665 nm. Giá trị (84) cho ở đây là cho clorophyl-b và clorophyl-c. Độ hấp thụ của clorophyl-a ở cùng nồng độ trong axeton cao hơn 2 % đến 3 % trong etanol ở 665 nm [2] [4].
8.4 Ghi kết quả bằng microgam trên lit (hoặc miligam trên mét khối) với hai số có nghĩa hoặc một số sau dấu phẩy, thí dụ:
Nồng độ clorophyl-a 5,5 μg/l
Nồng độ phaeopigment < 0,1="">
9 Độ chính xác
Một phép thử liên phòng thí nghiệm thực hiện 1983 cho kết quả [6] ghi trong bảng 1.
Bảng 1 - Độ chính xác
|
Mẫu |
l |
n |
na % |
μg/l |
σr μg/l |
VCr % |
σR μg/l |
VCR % |
|
A B C |
18 18 17 |
71 70 67 |
0 2,8 5,6 |
126,5 20,3 24,6 |
5,46 3,67 2,21 |
4,3 18,1 9,0 |
6,36 2,90 2,8 |
5,0 11,3 11,4 |
|
l là số phòng thí nghiệm σr là độ lệch chuẩn lặp lại n là số giá trị VCr là hệ số độ lệch lặp lại na là phần trăm loại bỏ σR là độ lệch chuẩn tái lập
|
||||||||
10 Báo cáo kết quả
Báo cáo kết quả cần gồm những thông tin sau:
a) viện dẫn tiêu chuẩn này;
b) nhận biết mẫu nước;
c) biểu diễn kết quả, theo điều 8;
d) xử lý mẫu trước, nếu có;
e) những sai khác so với phương pháp này hoặc mọi tình huống có thể ảnh hưởng đến kết quả.
Phụ lục A
(tham khảo)
XÁC ĐỊNH HÀM LƯỢNG THỰC VẬT ĐÁY
A.1 Xác định thực vật đáy
Lấy mẫu thực vật phù du theo ISO 5667-1 và TCVN 5992: 1995 (ISO 5667-2).
Lấy mẫu thực vật đáy (tảo bám vào) phụ thuộc vào chất nền. Một vùng diện tích bề mặt xác định trên đá hoặc trên vật liệu khác chìm trong nước có thể được nạo ra bằng dao hoặc lưỡi dao cạo râu.
Sỏi và đá nhỏ lấy trực tiếp vào dung môi. Vật liệu nhân tạo đặt xuống nước như một miếng thủy tinh làm cho việc lấy mẫu trở nên dễ dàng. Cả miếng thủy tinh hoặc tảo được lấy ra và vận chuyển từ nơi lấy mẫu cùng với nước. Tảo đáy hoặc chất nền với khối lượng đã biết sẽ được xử lý tương tự như với thực vật phù du theo phương pháp mô tả ở tiêu chuẩn này.
A.2 Dung môi chiết
Axeton được dùng nhiều vì nó được UNESCO-SCOR đề nghị vào năm 1966 để chiết tảo. Tuy nhiên, trong một số trường hợp axeton tỏ ra không được tốt nên được thay bằng cồn. Thực nghiệm đã chỉ ra rằng etanol và metanol nóng là tương tự nhau và chiết tốt hơn axeton lạnh [4]. Nhưng nếu axit hóa phần chiết để hiệu chỉnh ảnh hưởng của phaeopicment thì sinh ra vấn đề. Sự lệch của độ hấp thụ cực đại về phía các sóng ngắn hơn có thể dẫn đến sự thay đổi tỷ số axit, thí dụ nồng độ axit, hàm lượng nước trong dung môi và cái lọc, thời gian từ lúc axit hóa đến lúc đo. Những vấn đề này chỉ có thể khắc phục bằng cách thêm các bước trong phương pháp, thí dụ trung hòa bằng bazơ hữu cơ (dimetyl anilin hoặc diphenyl anilin). Ngoài ra, mêtanol rất độc. Vì thế, khuyến nghị dùng etanol làm chất chiết để xác định clophyl-a trong mẫu nước ngọt và nước biển.
Phụ lục B
(tham khảo)
TÀI LIỆU THAM KHẢO
[1] TOLSTOY, A. và TOTH, I., Bacterio clorophyl-d và ảnh hưởng của nó đến xác định clorophyl-a, Arch. Hydro biol.89 (1980), tr 160 - 170.
Bacterio clorophyl-d and its interference on determination of chlorophyll-a Arch. Hydro biol.
89 (1980),pp.160-170
[2] NUSCH, E.A., So sánh các phương pháp khác nhau để xác định clorophyl và phaeopigment, Arch. Hydrobiol.Ergebn.Limnol.14 (1980). tr 14-36.
Comparison of different methods for chlorophyll and phaeopigment determination, Arch.
Hydrobiol.Ergebn.Limnol.14 (1980), pp. 14-36
[3] LORENZEN, C. J., Xác định clorophyll và phaeopigment, phương trình trắc quang, Limmol.
oceanogr.12 (1967), tr. 343-346.
Determination of chlorophyll and phaeopigments; spectrophotometric equations, Limmol.
oceanogr.12 (1967), pp. 343-346.
[4] MARKER, A.F.H., NUSCH, E.A, RAI, H. và RIEMANN, B. Đo các pigment quang hợp trong nước ngọt và những phương pháp tiêu chuẩn hóa: kết luận và đề nghị, Arch. Hydrobiol Beich.
Ergebn.Limnol, 14 (1980) tr. 91-106.
The mesurement of photosynthetic pigments in frestwaters and standardization of methods:
Conclusions and recommentdations. Arch. Hydrobiol Beich. Ergebn.Limnol, 14 (1980) pp. 91-106.
[5] VOLLENWEIDER, R.A, Những phương pháp đo dự phát triển trong môi trường nước. IBP
Handbook No12, xuất bản lần thứ hai (1971) Blackwell Scient Publ.Oxford. Edinburgh.
A manual on methods of measuring primary production in aquatic environments, IBP Handbook No 12, 2nd ed. (1971) Blackwell Scient Publ.Oxford. Edinburgh.
[6] NISCH, E.A., những kết quả thử liên phòng thí nghiệm . Xác định clorophyl-a.Z. Wasser Abw.Forsch.17, (1984), tr 189-194.
Results from an interlaboratory ring test concerning the determination of chlorophyll a. Z. Wasser Abw.Forsch.17, (1984), pp. 189-194.
