Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6917:2001 (ISO 9888 : 1999) về chất lượng nước - đánh giá sự phân huỷ sinh học ưa khí cuối cùng của các hợp chất hữu cơ trong môi trường nước - phép thử tĩnh (phương pháp zahn-wellens) do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6917 : 2001
ISO 9888 : 1999
CHẤT
LƯỢNG NƯỚC - ĐÁNH GIÁ SỰ PHÂN HUỶ SINH HỌC ƯA KHÍ CUỐI CÙNG CỦA CÁC HỢP CHẤT
HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC - PHÉP THỬ TĨNH (PHƯƠNG PHÁP ZAHN-WELLENS)
Water quality - Evaluation of ultimate aerobic biodegradability of organic
compounds in aqueous medium - Static test (Zahn-Wellens method)
Lời nói đầu
TCVN 6917 : 2001 hoàn toàn tương đương với ISO 9888 : 1999.
TCVN 6917 : 2001 do Ban kỹ thuật tiêu chuẩn TCVN / TC 147
"Chất lượng nước" biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
CHẤT LƯỢNG NƯỚC - ĐÁNH GIÁ SỰ PHÂN HUỶ SINH HỌC ƯA KHÍ CUỐI CÙNG CỦA CÁC HỢP CHẤT HỮU CƠ TRONG MÔI TRƯỜNG NƯỚC - PHÉP THỬ TĨNH (PHƯƠNG PHÁP ZAHN-WELLENS)
Water quality - Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium - Static test (Zahn-Wellens method)
Cảnh báo: Bùn hoạt hoá và nước cống có thể chứa nhiều vi sinh vật gây bệnh. Phải cẩn thận khi làm việc với chúng. Chú ý cẩn thận khi làm việc với những hợp chất thử có độc tính và các chất mà chưa biết rõ bản chất.
1 Phạm vi áp dụng
Tiêu chuẩn này qui định phương pháp đánh giá sự phân huỷ sinh học "cuối cùng" trong môi trường nước, sự phân huỷ sơ cấp và sự loại trừ hoàn toàn các hợp chất hữu cơ tại nồng độ đã cho ra khỏi nước bằng các vi sinh vật ưa khí.
Các điều kiện mô tả trong tiêu chuẩn này thường tương ứng với những điều kiện tối ưu cho phép sự phân huỷ sinh học xảy ra ở mức tối đa với chất cấy đã chọn trong thời gian thử. Những điều kiện này thậm chí còn thích hợp hơn trong các nhà máy xử lý nước thải hoàn chỉnh, đặc biệt là nếu thời gian lưu giữ nước, tuổi bùn hoặc sự thích ứng của bùn hoạt hoá không phải là tối ưu.
Phương pháp này áp dụng cho các hợp chất hữu cơ mà chúng
a) có thể hoà tan trong nước ở nồng độ sử dụng trong các điều kiện thử và không bị biến đổi thành chất chuyển hoá không tan khi không chỉ sự loại trừ mà cả sự phân huỷ sinh học được xác định.
b) không bay hơi hay có áp suất hơi có thể bỏ qua trong các điều kiện thử;
c) không mất đi khi dung dịch thử sủi bọt;
d) không gây ức chế cho các vi sinh vật thử tại nồng độ đã chọn cho phép thử. Tác động ức chế có thể được xác định bằng phương pháp thử thích hợp [xem TCVN 6226: 1996 (ISO 8192)]. Nếu hợp chất thử là chất độc, nồng độ thử phải thấp hoặc dùng chất cấy phơi nhiễm trước.
Tiêu chuẩn này cũng áp dụng để đo độ phân huỷ sinh học và sự loại trừ của hợp chất hữu cơ hoà tan trong nước thải (cũng được gọi là: "hợp chất thử" trong phương pháp).
Chú thích - Nếu cần thêm thông tin để dự đoán phản ứng của các chất thử hoặc nước thải trong nhà máy xử lý cần tiến hành một phép thử mô phỏng (ví dụ phép thử mô phỏng bùn hoạt hoá ISO 11733). Để sử dụng phù hợp phương pháp này và các phương pháp phân huỷ sinh học khác, xem ISO 15462.
2 Tiêu chuẩn trích dẫn
TCVN 6491:1999 (ISO 6060: 1989) Chất lượng nước - Xác định nhu cầu oxy hoá học.
TCVN 6634: 2000 (ISO 8245), Chất lượng nước - Hướng dẫn xác định cacbon hữu cơ tổng số (TOC) và cacbon hữu cơ hoà tan (DOC).
3 Thuật ngữ và định nghĩa
Trong tiêu chuẩn này, những định nghĩa sau đây được dùng
3.1 Sự phân huỷ sinh học ưa khí cuối cùng (ultimate aerobic biodegradation)
là sự phân huỷ các hợp chất hoá học hoặc chất hữu cơ bởi vi sinh vật ưa khí khi có oxy để tạo ra cacbondioxyt, nước và muối khoáng của các nguyên tố có mặt (sự khoáng hoá) và tạo ra sinh khối mới.
3.2 Sự phân huỷ sinh học sơ cấp (primary biodegradation)
là sự thay đổi cấu trúc (sự biến đổi) của hợp chất hoá học bởi vi sinh vật dẫn đến sự mất một tính chất nhất định.
3.3 Bùn hoạt hoá (activated sludge)
là sinh khối được tạo ra trong việc xử lý hiếu khí nước thải do sự phát triển của vi khuẩn và các vi sinh vật khác khi có oxy hoà tan.
3.4 Nồng độ chất rắn lơ lửng của bùn hoạt hoá (concentration of suspended solids of an activated sludge) là lượng chất rắn thu được bằng cách lọc hay ly tâm của một thể tích bùn hoạt hoá đã biết và sấy ở nhiệt độ khoảng 105 oC đến khối lượng không đổi.
3.5 Cácbon hữu cơ tổng số (total organic carbon)
TOC
là tất cả cacbon hữu cơ hoà tan hoặc lơ lửng trong nước.
3.6 Các bon hữu cơ hoà tan (dissolved organic carbon)
DOC
là phần cacbon hữu cơ trong nước không thể tách ra bằng sự tách pha cụ thể.
Chú thích - Sự tách pha có thể được qui định ví dụ bằng ly tâm ở 40000 m.s-2 trong 15 min hoặc bằng cách lọc qua màng có đường kính lỗ từ 0,2 μm đến 0,45 μm.
3.7 Nhu cầu oxy hoá học (chemical oxygen demand)
COD
là nồng độ khối lượng oxy tương đương với lượng chất oxy hoá tiêu thụ bởi hợp chất hoá học hoặc chất hữu cơ khi xử lý mẫu nước với chất oxy hoá trong những điều kiện xác định.
Chú thích - Trong trường hợp này, COD được thể hiện bằng miligam oxy tiêu thụ trên miligam hoặc gam hợp chất thử.
3.8 Pha trễ (lag phase)
là thời gian từ khi bắt đầu phép thử đến khi đạt được sự thích nghi và/hoặc sự lựa chọn của vi sinh vật phân huỷ và mức phân huỷ sinh học của hợp chất hoá học hoặc chất hữu cơ tăng khoảng 10 % so với mức phân huỷ sinh học tối đa.
Chú thích - Pha trễ được tính bằng ngày.
3.9 Mức phân huỷ sinh học tối đa (maximum level of biodegradation)
là mức phân huỷ sinh học tối đa của một chất hoá học hoặc chất hữu cơ trong một phép thử, mà nếu quá mức này thì không còn xảy ra sự phân huỷ sinh học trong khi thử. Chú thích - Mức phân huỷ sinh học tối đa được tính bằng phần trăm.
3.10 Pha phân huỷ sinh học (biodegradation phase)
là thời gian từ khi kết thúc pha trễ của phép thử đến khi đạt khoảng 90 % mức phân huỷ sinh học tối đa.
Chú thích - Pha phân huỷ sinh học được tính bằng ngày.
3.11 Pha tới hạn (pha bình ổn) (plateau phase)
là thời gian từ khi kết thúc pha phân huỷ sinh học đến khi kết thúc phép thử.
3.12 Phơi nhiễm trước (pre-exposure)
ủ trước một chất cấy khi có mặt chất thử hoá học hoặc chất hữu cơ với mục đích tăng khả năng phân huỷ sinh học của chất cấy này đối với chất thử bằng sự thích nghi và/hoặc lựa chọn của các vi sinh vật.
3.13 Thích nghi trước (preconditioning)
ủ trước một chất cấy vi sinh vật trong các điều kiện thử của phép thử sau đó nhưng không có hoá chất thử hoặc chất hữu cơ với mục đích cải thiện tính năng của phép thử bằng cách làm cho vi sinh vật thích nghi với điều kiện thử.
4 Nguyên tắc
Xác định sự phân huỷ sinh học hoặc sự loại trừ của các hợp chất hữu cơ hoà tan trong nước hoặc các thành phần nước thải do vi sinh vật ưa khí, dùng hệ thử thuỷ tĩnh. Hỗn hợp thử chứa môi trường vô cơ, bùn hoạt hoá như là một chất cấy hỗn hợp và các hợp chất thử hữu cơ như là một nguồn cacbon và năng lượng duy nhất ngoài bùn. Chọn lượng chất thử thêm vào sao cho kết quả nồng độ ban đầu của cacbon hữu cơ hoà tan (DOC) trong khoảng 50 mg/l đến 400 mg/l, hoặc nồng độ của nhu cầu oxy hoá học (COD) trong khoảng 100 mg/l đến 1000 mg/l, và phụ thuộc vào độ hoà tan trong nước của chất thử và độc tố của nó đối với vi khuẩn trong chất cấy.
Việc đo nồng độ của DOC (hay COD) được thực hiện từ đầu đến cuối phép thử (thường là 28 ngày) và tại những khoảng thời gian trung bình, nếu có yêu cầu. Để có được bất kỳ sự hấp phụ đáng kể nào của chất thử lên bùn, mẫu được lấy sau khi bắt đầu phép thử 3 h. Giá trị thu được tại thời điểm này được dùng làm cơ sở để tính phần trăm độ phân huỷ sinh học cuối cùng tại mỗi thời điểm lấy mẫu. Lưu ý thêm là sự loại trừ hoàn toàn của DOC hoặc COD từ pha nước có thể thu được bằng cách tính lượng tách ra dựa trên giá trị đo được trước khi thêm muối của môi trường thử và chất cấy. Các quá trình loại trừ phi sinh học khác, nếu có như giải phóng vào không khí, có thể xác định được bằng sự kiểm soát quá trình loại trừ phi sinh học không có chất cấy.
Sử dụng phép phân tích cụ thể có thể cho thông tin thêm về phân huỷ sinh học ban đầu của chất thử.
5 Môi trường thử
Phải tiến hành ủ trong tối hoặc ánh sáng khuếch tán, ở nhiệt độ trong khoảng 20 oC đến 25oC mà không dao động quá 2 oC trong suốt quá trình thử và tại nơi kín trong đó không có hơi hoặc khí độc đối với vi sinh vật.
6 Thuốc thử
Chỉ dùng thuốc thử loại tinh khiết phân tích, bao gồm:
6.1 Nước cất hoặc nước đã loại ion, chứa ít hơn 1 mg/l DOC.
6.2 Môi trường thử
6.2.1 Thành phần
6.2.1.1 Dung dịch a)
Kali dihydrophosphat khan (KH2PO4) 8,5 g
Dikali hydrophosphat khan (K2HPO4) 21,75 g
Dinatri hydrophosphat ngậm 2 nước (Na2HPO4.2H2O) 33,4 g
Amoni clorua (NH4Cl) 0,5 g
Hoà tan trong nước (6.1) và làm đầy đến 1000 ml.
Chú thích - Để kiểm tra dung dịch đệm này, cần đo pH. Nếu pH không bằng 7,4 thì phải pha dung dịch mới.
6.2.1.2 Dung dịch b)
Hoà tan 22,5 g magie sunphat ngậm 7 nước (MgSO4.7H2O) trong nước (6.1) và thêm nước đến 1000 ml.
6.2.1.3 Dung dịch c)
Hoà tan 36,4 g canxi clorua ngậm 2 nước (CaCl2.2H2O) trong nước (6.1) và thêm nước đến 1000 ml.
6.2.1.4 Dung dịch d)
Hoà tan 0,25 g sắt (III) clorua ngậm 6 nước (FeCl3.6H2O) trong nước (6.1) và thêm nước đến 1000 ml. Chuẩn bị dung dịch này ngay trước khi sử dụng hoặc thêm một giọt axit clohydric (HCl) đậm đặc để tránh kết tủa.
6.2.2 Chuẩn bị môi trường thử
1000 ml môi trường thử phải chứa 10 ml dung dịch a) và 1 ml mỗi dung dịch b), c), d). Thêm lượng đúng dung dịch gốc như nêu ở 8.3. Chuẩn bị môi trường thử ngay trước khi dùng. Các dung dịch a), b), c), bảo quản được 6 tháng trong tối ở nhiệt độ phòng.
Chú thích - Nếu chất thử ảnh hưởng đến giá trị pH của hỗn hợp tại nồng độ thử đã chọn, thì phải tăng thể tích dung dịch đệm của môi trường thử. Nếu nồng độ phép thử cao có thể xảy ra sự thiếu nitơ. Trong các trường hợp này, nên cải thiện thành phần dinh dưỡng của môi trường thử bằng cách thêm, ví dụ, khoảng 100 ml dung dịch a) thay cho 10 ml dung dịch a) hoặc một lượng phosphat của dung dịch a). Tỉ lệ C: N: P ở nồng độ dung dịch thử 400 mg/l DOC thay đổi từ 100:0,3:30 lên 100:0,3:300. Vì ở nồng độ nitơ cao, quá trình nitrat hoá có thể xảy ra do đó để giữ cho pH ổn định thì nồng độ dung dịch đệm phosphat phải cao hơn.
6.3 Dung dịch natri hydroxit
Hoà tan dung dịch natri hydroxit (NaOH) trong nước (6.1) để thu được dung dịch có nồng độ 0,1 mol/l đến 0,5 mol/l.
6.4 Dung dịch axit clohydric
Hoà tan dung dịch axit clohydric (HCl) trong nước (6.1) để thu được dung dịch có nồng độ từ 0,1 mol/l đến 0,5 mol/l.
6.5 Dung dịch thuỷ ngân clorua
Hoà tan 1 g thuỷ ngân (II) clorua (HgCl2) trong 100 ml nước (6.1).
7 Thiết bị, dụng cụ
Sử dụng các thiết bị phòng thí nghiệm thông thường và các thiết bị dụng cụ sau:
7.1 Bình thuỷ tinh, dung tích 1 lit đến 5 lit có bộ phận khuấy là que khấy bằng thuỷ tinh hay bằng kim loại; bộ phận quay đảm bảo trộn tốt.
Mỗi bình phải nối khít với các ống thuỷ tinh có đường kính trong từ 2-4 mm để dẫn khí. Khí phải không chứa cacbon hữu cơ và hơi độc và phải được bão hoà trước với hơi nước để giảm lượng mất do bay hơi.
Các dụng cụ thuỷ tinh phải được rửa sạch cẩn thận và đặc biệt là không chứa các vết chất hữu cơ, chất độc.
7.2 Thiết bị đo, đủ nhậy để đo được cacbon hữu cơ hoà tan [xem TCVN 6634: 2000 (ISO 8245)] hoặc đo nhu cầu oxy hoá học [TCVN 6491 (ISO 6060)] và nếu cần, cho các phân tích chất cụ thể.
7.3 Máy ly tâm hoặc dụng cụ lọc, có cái lọc bằng giấy hoặc màng lọc (cỡ lỗ/đường kính lỗ danh định từ 0,2 đến 0,45 àm) , có thể hấp phụ hoặc giải phóng cacbon hữu cơ ở mức tối thiểu.
7.4 pHmet (thông thường ở phòng thí nghiệm)
8 Cách tiến hành
8.1 Chuẩn bị dung dịch thử
8.1.1 Dung dịch chất thử trong nước (6.1) hoặc trong môi trường thử (6.2.2), ở nồng độ thích hợp (ví dụ 3000 mg/l).
Trong trường hợp đối với nước thải, xác định TOC, DOC, pH. Phép thử được chấp nhận đối với nước thải nếu DOC >90% TOC, điều đó chỉ ra một cách đầy đủ là hợp chất hoà tan trong nước đối với phương pháp này dựa trên phép đo DOC. Thêm nước thải trực tiếp hoặc pha loãng trong nước (6.1) để có nồng độ chất thử mong muốn. Nếu nước thải có giá trị pH ngoài giới hạn (<3 hoặc="">10) thì trung hoà bằng dung dịch natri hydroxit (6.3) hoặc bằng dung dịch axit clohydric (6.4) để pH đạt 7± 1.
8.1.2 Dung dịch chất đối chứng trong nước (6.1) hoặc trong môi trường thử (6.2.2) ở nồng độ thích hợp (ví dụ 3000 mg/l). Dùng chất hữu cơ hoà tan trong nước đã biết khả năng phân huỷ sinh học (ví dụ dietylen glycol, etylen glycol, natri benzoat hoặc anilin), có mức độ phân huỷ > 90 %).
8.2 Chuẩn bị dung dịch cấy
Lấy mẫu bùn hoạt hoá từ bể sục khí của trạm xử lý nước thải sinh học. Trộn mẫu kỹ và rửa bùn hoạt hoá nhiều lần (ví dụ 2 đến 3 lần) thêm nước máy hoặc môi trường thử (6.2), ly tâm hoặc để lắng và gạn bỏ phần nước trong ở trên. Trước khi dùng, xác định nồng độ chất rắn lơ lửng [ví dụ xem TCVN 6625: 2000 (ISO 11923)]. Nếu cần, cô đặc bùn bằng cách để lắng sao cho thể tích bùn thêm vào để có được nồng độ chất rắn lơ lửng theo yêu cầu (khoảng 10% tổng thể tích) là nhỏ nhất. Bảo quản chất cấy ở nơi thoáng khí tại nhiệt độ phòng đến khi sử dụng.
Chú thích - Tuỳ thuộc vào mục đích của phép thử, nhà máy xử lý nước thải nên lấy nước thải ở trung tâm đô thị lớn. Bùn hoạt hoá cũng có thể được lấy từ trạm xử lý nước thải thử nghiệm. Để có thể lấy càng nhiều loài hoặc chủng vi khuẩn khác nhau càng tốt, nhất là trong những trường hợp đặc biệt cần tạo một hỗn hợp từ nhiều nguồn khác nhau. Việc cấy phơi nhiễm trước có thể được sử dụng trong những trường hợp nhất định. Khi sử dụng phép cấy này nên ghi rõ ở kết quả thử (ví dụ phần trăm phân huỷ sinh học sử dụng cấy phơi nhiễm) và ghi lại chi tiết phương pháp cấy phơi nhiễm trước trong báo cáo kết quả. Chất cấy phơi nhiễm trước có thể có được từ một phép thử phân huỷ sinh học phòng thử nghiệm tiến hành trong các điều kiện thích hợp khác nhau. Các phép thử phù hợp là ví dụ phép thử Zahn-Wellens [TCVN 6917: 2001 (ISO 9888)] đã được tiến hành với hợp chất thử (xem 8.3) hoặc phép thử SCAS (ISO 9887). Chất cấy cũng có thể thu được từ những nơi có các điều kiện môi trường tương ứng (ví dụ nhà máy xử lý nước thải tiến hành với các chất tương tự).
8.3 Tiến hành thử
Lấy đủ số bình thuỷ tinh (7.1) để có
- ít nhất một bình (ký hiệu FT) chứa chất thử (8.1.1)
- ít nhất một bình (ký hiệu FB) chứa môi trường thử và chất cấy;
- ít nhất một bình dùng để kiểm tra qui trình (ký hiệu Fc)chứa chất đối chứng (8.1.2);
- (khi cần) một bình để kiểm tra sự loại trừ phi sinh học (ký hiệu FS) chứa chất thử (8.1.1) nhưng không chứa chất cấy đã được diệt khuẩn ví dụ bằng cách thêm chất độc vô cơ thích hợp để ngăn cản hoạt động của vi sinh vật.
Chú thích - Dùng ví dụ 1 ml/l dung dịch thuỷ ngân (II) clorua (6.5). Thêm cùng một lượng chất độc hai tuần sau khi bắt đầu phép thử.
Dùng bình thuỷ tinh thích hợp để thu được thể tích thử cuối cùng, ví dụ 3 l. Có thể dùng thể tích thử cuối cùng khác trong trường hợp đó điều chỉnh tất cả các thông số liên quan và việc tính toán kết quả thử. Thể tích đã chọn phụ thuộc vào số lượng mẫu được lấy để xác định DOC, COD và thể tích cần thiết cho qui trình phân tích. Chuẩn bị hỗn hợp thử như ở bảng 1.
Thêm vào bình khoảng 2/3 nước thử yêu cầu (6.1). Sau đó thêm dung dịch chất thử hoặc nước thải (8.1.1) để có được nồng độ DOC từ 50 mg/l đến 400 mg/l hoặc nồng độ COD từ 100 mg/l đến 1000 mg/l trong hỗn hợp cuối cùng tương ứng bình FT. Lấy mẫu (thời gian t0) và xác định nồng độ DOC hoặc COD. Liên hệ giá trị đo với thể tích thử cuối cùng và dùng giá trị này để tính sự loại trừ tổng số dưạ trên t0 [xem công thức (2) trong 9.1].
Thêm lượng cần thiết các dung dịch 6.2.1 để có được môi trường thử có thể tích thử cuối cùng. Đo giá trị pH và nếu cần điều chỉnh pH đến 7 ± 0,5 bằng axit vô cơ (xem 6.4) hoặc dung dịch kiềm (xem 6.3). Thêm bùn hoạt hoá (8.2) như là chất cấy. Điều chỉnh nồng độ bùn đến nồng độ ban đầu của chất thử. Dùng 0,2 g/l chất rắn lơ lửng cho 50 mg/l DOC và 1 g/l cho 400 mg/l DOC trong hỗn hợp cuối cùng. Đối với nồng độ trong khoảng 50 mg/l đến 400 mg/l thì dùng nồng độ bùn nằm trong khoảng này. Đổ nước (6.1) tới thể tích cuối cùng, trộn chất chứa trong các bình một cách riêng biệt.
Bảng 1 - Phân phối cuối cùng chất thử và chất đối chứng
|
Bình |
Môi trường thử (6.2) |
Chất thử (8.1.1) |
Chất đối chứng (8.1.2) |
Chất cấy (8.2) |
|
Chất thử FT |
+ |
+ |
- |
+ |
|
Trắng FB |
+ |
- |
- |
+ |
|
Kiểm tra chất cấy FC |
+ |
- |
+ |
+ |
|
Kiểm tra sự loại trừ phi sinh học FS(lựa chọn) |
+ |
+ |
- |
- |
Tạo bình trắng FB và chất đối chứng (8.1.2) vào trong bình FC, để tiến hành song song với mỗi loạt phép thử. Bình FB chỉ chứa chất cấy có nồng độ chất rắn lơ lửng và tổng thể tích giống như bình thử. Thử chất đối chứng tại nồng độ giống như nồng độ chất thử.
Nếu chất thử bị loại trừ bằng quá trình phi sinh học, đặc biệt là thoát vào không khí, tạo bình để kiểm soát sự loại trừ phi sinh học (FS) (lựa chọn) không sử dụng chất cấy và thêm 10 ml/l dung dịch thuỷ ngân (II) clorua (6.5) hoặc chất độc vô cơ thích hợp khác.
Để bắt đầu phép thử, lắc các bình bằng máy lắc, sục khí cacbonic và ủ ở nhiệt độ thử đã định (xem điều 5). Trong suốt quá trình thử cần đảm bảo bùn được sục khí tốt và không bị để lắng. Để bù lượng nước do bay hơi cần kiểm tra thể tích môi trường trong các bình trước mỗi lần lấy mẫu và, nếu cần, thêm nước (6.1) vào thể tích hoặc khối lượng đã đo sau lần lấy mẫu trước. Kiểm tra giá trị pH tại các khoảng thông thường, đặc biệt là nếu bùn nitơ hoá (ví dụ như mẫu dùng để phân tích) và điều chỉnh giá trị pH 7,0 ± 0,5 nếu cần.
Lấy một thể tích nhỏ nhất mẫu thử cho ly tâm ở 40.000 m/s2 trong 15 min hoặc lọc các phần mẫu này cẩn thận qua giấy lọc rửa (7.3). Đặc biệt nếu dịch lọc không sạch, dùng màng lọc (7.3) thay cho giấy lọc để lọc mẫu. Đo nồng độ DOC hoặc COD trong những mẫu này ít nhất 2 lần. Nếu sự phân huỷ sơ cấp xảy ra sau đó thì sử dụng phép phân tích chất cụ thể.
Thực hiện phép phân tích càng sớm càng tốt. Nếu phép đo bị chậm đến 48 h, bảo quản mẫu trong tối ở 4 oC và trong chai được nút chặt. Nếu bảo quản mẫu quá 48 h, thì cần thêm vào 20 ml/l dung dịch thuỷ ngân (II) clorua (6.5) hoặc chất độc vô cơ khác để ngăn cản hoạt tính của vi sinh vật và giữ mẫu ở 4oC. Nếu thêm ion Cl- thì phải cẩn trọng khi thực hiện phép đo COD ở nồng độ thấp. Bảo quản mẫu ở -18 oC thay cho việc thêm chất độc.
Lấy mẫu sau khi bắt đầu phép thử (3 ± 3,5) h (thời gian t1), giữa hai phép đo liên tiếp tại thời điểm kết thúc của phép thử (thường là ngày 27 và ngày 28) và vào ít nhất ba khoảng thời gian trung bình (ví dụ 7 ngày, 14 ngày, và 21 ngày). Thường thì giai đoạn thử tối đa không quá 28 ngày. Nếu mức DOC tách ra đủ thì sẽ đạt đến pha tới hạn và không có thêm quá trình loại trừ nào thì phép thử được coi là hoàn tất. Nếu sự phân huỷ chắc chắn đã bắt đầu nhưng không đạt được pha giới hạn thì phải kéo dài phép thử 1 đến 2 tuần cho đến khi đạt được pha tới hạn.
Nếu xác định được sự phân huỷ sinh học có cấy phơi nhiễm trước thì có thể lặp lại phép thử dùng chất cấy đã có ở phép thử trước. Trong trường hợp này rửa bùn hoạt hoá còn sót lại, nếu cần, trộn đều với bùn sạch để có được nồng độ chất rắn lơ lửng yêu cầu và lặp lại phép thử.
9 Tính toán và biểu thị kết quả
9.1 Tính toán
Tính phần trăm DOC hoặc COD tách ra trong mỗi bình dùng công thức (1). Xác định sự phân huỷ sinh học (Dt) dùng giá trị nồng độ đo được tại t1 (3 ± 0,5) h. Giá trị này, thu được sau khi thêm muối của môi trường thử (6.2.1), trung hoà và thêm chất cấy, được coi là lượng bị loại trừ do sự hấp phụ vì sau thời gian này, sự hấp phụ và sự giải hấp trong hầu hết các trường hợp là cân bằng.
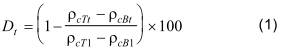
trong đó
ρcT1 là nồng độ DOC tại thời điểm t1 trong bình FT, tính bằng miligam trên lít;
ρcB1 là nồng độ DOC tại thời điểm t1 trong bình FB, tính bằng miligam trên lít;
ρcTt là nồng độ DOC tại thời điểm t trong bình FT, tính bằng miligam trên lít;
ρcBt là nồng độ DOC tại thời điểm t trong bình FB, tính bằng miligam trên lít;
Nếu đo COD thì cũng dùng công thức trên. Cũng theo cách như trên, tính độ phân huỷ sinh học của chất đối chứng Fc và của phép kiểm tra sự loại trừ phi sinh học FS (không cần xét đến ρcB1 và ρcBt).
Trong trường hợp hấp phụ các chất, nồng độ COD hoặc DOC tại (t1) sau (3 ± 0,5) h có thể nhỏ hơn đáng kể (>20%) so với giá trị tại thời gian t0. Trong trường hợp này, phép thử tĩnh không phân biệt được giữa sự phân huỷ sinh học và sự hấp phụ. Để có thêm thông tin, tính sự loại trừ tổng số De dùng công thức (2).
![]()
trong đó
ρcT1 là nồng độ DOC tại thời điểm t0 trong bình FT, tính bằng miligam trên lít;
Khi tiến hành phép phân tích hợp chất thử cụ thể, tính phần trăm độ phân huỷ sinh học sơ cấp DS của chất thử so với lượng trong bình FS dùng công thức (3)
![]()
trong đó
ρT là nồng độ của chất thử trong bình FT tại thời điểm t; tính bằng miligam trên lít
ρS là nồng độ chất thử trong bình FS tại thời điểm t, tính bằng miligam trên lít.
9.2 Biểu thị kết quả
Lập bảng các giá trị đo được và phần trăm sự loại trừ phi sinh học cho mỗi khoảng đo và mỗi bình thử. Dựng đường cong phân huỷ sinh học dựa trên Dt và DS và /hoặc đường cong sự loại trừ phi sinh học dựa trên De (tính bằng phần trăm) theo thời gian (xem phụ lục A). Chỉ ra pha trễ và pha phân huỷ tính bằng ngày. Lập đường cong phân huỷ sinh học của chất đối chứng FC theo cách tương tự, nếu cần đưa vào cả đường cong sự loại trừ phi sinh học của bình kiểm tra sự loại trừ phi sinh học FS.
Xác định giá trị trung bình phần trăm phân huỷ sinh học (hoặc loại trừ, xem 9.3) trong pha tới hạn hoặc dùng giá trị lớn nhất, ví dụ khi đường cong giảm ở trong pha tới hạn, và chỉ ra mức phân huỷ sinh học hoặc mức loại trừ tối đa như "mức độ phân huỷ sinh học hoặc mức loại trừ của chất thử" trong báo cáo thử nghiệm.
9.3 Chỉ thị sự phân huỷ sinh học
Nếu kết quả phép phân tích mẫu đầu tiên (t1) sau ( 3 ± 0,5) h khác nhiều so với giá trị t0, thì phải ghi lượng thiếu hụt DOC hoặc COD là " được hấp thụ bởi bùn hoạt hoá trong phép thử tĩnh". Nếu trong bình FS (nếu bao gồm cả phép kiểm tra sự loại trừ phi sinh học) thấy lượng DOC hoặc COD giảm đáng kể (>20%) thì có thể đã xảy ra một quá trình loại trừ phi sinh học khác.
Nếu sự hấp phụ yếu (ví dụ nhỏ hơn 20%) và không có sự loại trừ phi sinh học đáng kể (ví dụ nhỏ hơn 20% trong bình FS) xảy ra, thì có được đường cong phân huỷ sinh học điển hình với pha trễ, pha phân huỷ và pha tới hạn (xem ví dụ phụ lục A) hoặc khi có sẵn thông tin khác về khả năng phân huỷ sinh học của chất thử, thì coi sự loại trừ đo được của chất thử như là sự phân huỷ sinh học. Nếu xảy ra sự hấp phụ ban đầu lớn thì phép thử tĩnh không thể phân biệt giữa quá trình loại trừ sinh học và phi sinh học.
Chú thích - Để nhận được thông tin xác định về sự phân huỷ sinh học của các chất thử trong trường hợp không rõ ràng, cần thực hiện một phép thử dựa trên sự tiêu thụ oxy, ví dụ phép thử hô hấp theo ISO 9408 hoặc dựa trên sự sinh ra cacbon dioxit như TCVN 6489:1999 (ISO 9439) hay phép thử thích hợp khác (xem ISO 15462). Trong trường hợp này, chất cấy thích hợp của phép thử tĩnh [TCVN 6917: 2001 (ISO 9888)] nên được sử dụng, khi có sẵn.
10 Tính đúng của kết quả
Phép thử được coi là đúng nếu phần trăm phân huỷ trong bình FC (kiểm tra chất cấy) lớn hơn 70% ở ngày thứ 14. Nếu giá trị này không đạt được thì phải làm lại, ví dụ dùng chất cấy khác.
11 Báo cáo thử nghiệm
Báo cáo thử nghiệm ít nhất phải bao gồm các thông tin sau a) trích dẫn tiêu chuẩn này;
b) mọi thông tin cần thiết để nhận dạng chất thử hoặc nước thải;
c) nồng độ chất thử trong bình thử và hàm lượng DOC hoặc COD ở nồng độ này;
d) nguồn, nồng độ chất rắn lơ lửng và mọi thông tin về xử lý trước bùn hoạt hoá;
e) nhiệt độ ủ của phép thử;
f) thông số phân tích đã dùng (DOC, COD, phân tích chất cụ thể) và phương pháp xác định;
g) tất cả số liệu đo được và tính được (ví dụ dạng bảng) và đường cong phân huỷ của chất thử;
h) lượng phân huỷ sinh học, loại trừ tổng số và hấp thụ của chất thử, biểu thị bằng phần trăm;
i) tên của chất đối chứng đã dùng, đường cong phân huỷ và phần trăm phân huỷ của nó;
j) lượng loại trừ phi sinh học ở bình FS, nếu có làm;
k) lý do loại bỏ phép thử;
l) bất cứ thao tác nào có trong tiêu chuẩn này ảnh hưởng tới kết quả phép thử.
Phụ lục A
(tham khảo)
Ví dụ về đường cong phân huỷ sinh học
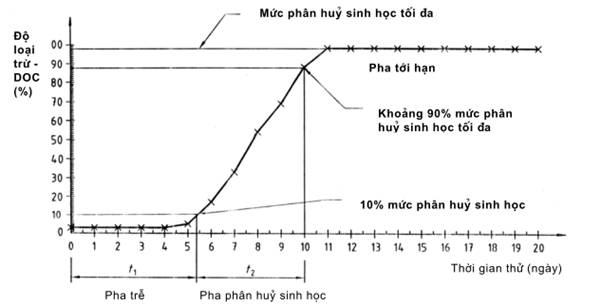
Hình A.1 - Sự phân huỷ sinh học của dietylen glycol trong phép thử tĩnh
TÀI LIỆU THAM KHẢO
[1] TCVN 6621: 2000 (ISO 7827: 1994) Chất lượng nước - Đánh giá sự phân huỷ sinh học hiếu khí cuối cùng của các hợp chất hữu cơ trong môi trường nước - Phương pháp phân tích cacbon hữu cơ hoà tan (DOC).
[2] TCVN 6226: 1996 (ISO 8192: 1986) Chất lượng nước - Thử sự ức chế khả năng tiêu thụ oxy của bùn hoạt hoá.
[3] TCVN 6827: 2001 (ISO 9408) Chất lượng nước - Đánh giá sự phân huỷ sinh học hiếu khí cuối cùng của các hợp chất hữu cơ trong môi trường nước bằng cách xác định nhu cầu oxy trong máy hô hấp kín.
[4] TCVN 6489: 1999 (ISO 9439) Chất lượng nước - Đánh giá khả năng phân huỷ sinh học hiếu khí hoàn toàn của các chất hữu cơ trong môi trường nước - Phương pháp dựa trên sự phân tích cacbon dioxit được giải phóng.
[5] ISO 9887 Water quality - Evaluation of ultimate aerobic biodegradability of organic compounds in aqueous medium - Carbon dioxide evolution test.
[6] ISO 11733: 1995 Water quality - Evaluation of the aerobic biodegradability of organic compounds in aqueous medium - Semi-continuous activated sludge method (SCAS).
[7] TCVN 6625: 2000 (ISO 11923: 1997) Chất lượng nước - Xác định chất rắn lơ lửng bằng cách lọc qua cái lọc sợi thuỷ tinh.
[8] ISO/TR 15462: 1997, Water quality - Selection of tests for biodegradability.







