Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 8378:2010 về tôm và sản phẩm tôm – Phát hiện virut gây bệnh đầu vàng (YHV) bằng kỹ thuật - Phản ứng chuỗi trùng hợp - Phiên mã ngược (RT-PCR)
TIÊU CHUẨN QUỐC GIA
TCVN 8378:2010
TÔM VÀ SẢN PHẨM TÔM –
PHÁT HIỆN VIRUT GÂY BỆNH ĐẦU VÀNG (YHV) BẰNG KỸ THUẬT
PHẢN ỨNG CHUỖI TRÙNG HỢP - PHIÊN MÃ NGƯỢC (RT-PCR)
Shrimp and shrimp products –
Detection of yellow head virus (YHV) by reverse transcription - polymerase chain reaction (RT-PCR)
Lời nói đầu
TCVN 8378 : 2010 do Cục Quản lý Chất lượng Nông Lâm sản và Thuỷ sản biên soạn, Bộ Nông nghiệp và Phát triển Nông thôn đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
CẢNH BÁO – Để đảm bảo an toàn cho nhân viên, các thao tác phân tích chỉ được thực hiện trong các phòng thử nghiệm được trang bị thích hợp, dưới sự kiểm soát của cán bộ thử nghiệm có kinh nghiệm. Etidi bromua (EB) là chất có khả năng gây ung thư. Vì vậy phải mang găng tay, đeo kính và mặc quần áo bảo hộ để tránh tiếp xúc. Nên đánh dấu rõ ràng thiết bị và dụng cụ tiếp xúc với EB và không di chuyển chúng ra khỏi khu vực quy định. Để chất thải có chứa EB trong vật chứa và có phương pháp loại bỏ thích hợp.
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện virut gây bệnh đầu vàng (YHV) trên tôm và các sản phẩm của tôm thuộc chi Tôm he (Penaeus) bằng kỹ thuật phản ứng chuỗi trùng hợp - phiên mã ngược (RT-PCR).
2. Tài liệu viện dẫn
Các tài liệu viện dẫn sau là rất cần thiết cho việc áp dụng tiêu chuẩn này. Đối với các tài liệu viện dẫn ghi năm công bố thì áp dụng phiên bản được nêu. Đối với các tài liệu viện dẫn không ghi năm công bố thì áp dụng phiên bản mới nhất, bao gồm cả các sửa đổi, bổ sung (nếu có).
ISO 22174 : 2005, Microbiology of food and animal feeding stuffs – Polymerase chain reaction (PCR) for the detection of food-borne pathogens – General requirements and definitions (Vi sinh vật trong thực phẩm và thức ăn chăn nuôi – Phản ứng chuỗi trùng hợp để phát hiện sinh vật gây bệnh từ thực phẩm – Yêu cầu chung và định nghĩa).
3. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này áp dụng các thuật ngữ và định nghĩa sau:
3.1 Virut gây bệnh đầu vàng (YHV) [Yellow head virus (YHV)]
Virut Corona, thuộc chi Okavirus, họ Ronivirida, bộ Nidovirales, vật chất di truyền là RNA, kích thước khoảng 22 kb, mã hóa cho 4 sợi polypeptide có kích thước là 170, 135, 67 và 22 kDa.
3.2 Phát hiện virut gây bệnh đầu vàng (Detection of yellow head virus)
Việc xác định sự có hoặc không có virut YHV (3.1) trong một khối lượng cụ thể của sản phẩm khi tiến hành thử nghiệm theo tiêu chuẩn này.
4. Nguyên tắc
4.1 Phương pháp phân tích định tính này dựa vào việc xác định đoạn RNA có chuyển thành cDNA hay không và cDNA đích có được khuếch đại hay không. Quá trình xác định được thực hiện bằng cách điện di sản phẩm sau khuếch đại trên bảng thạch, nhuộm màu DNA và quan sát dưới ánh sáng UV có bước sóng là 302 nm.
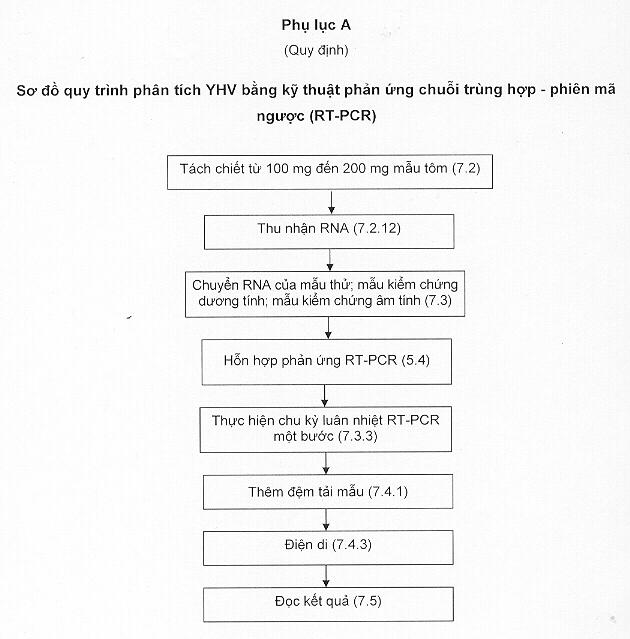
4.2 Quy trình phát hiện YHV bằng kỹ thuật RT-PCR cần qua năm giai đoạn kế tiếp nhau: tách chiết RNA; phiên mã ngược RNA thành cDNA; khuếch đại cDNA; điện di để phát hiện cDNA và đọc kết quả (xem thêm Phụ lục A).
5. Thuốc thử và vật liệu thử
Trong mọi trường hợp, chỉ sử dụng các thuốc thử tinh khiết phân tích thích hợp cho các ứng dụng sinh học phân tử. Việc pha chế, bảo quản và sử dụng thuốc thử phải tuân thủ theo hướng dẫn của nhà sản xuất. Nhìn chung, nên lấy lượng cần thiết vừa đủ các dung dịch phản ứng cho phép thử PCR và bảo quản chúng trong điều kiện thích hợp.
5.1 Mồi
Mồi đặc hiệu của virut YHV sử dụng trong kỹ thuật RT-PCR một bước gồm có mồi xuôi (10F) và mồi ngược (144R) hoặc cặp mồi 273F/R. Trình tự mồi cụ thể như sau:
|
Mồi |
Trình tự |
Sản phẩm |
|
10F |
5’-CCG-CTA-ATT-TCA-AAA-ACT-ACG-3’ |
135 bp |
|
144R |
5’-AAG-GTG-TTA-TGT-CGA-GGA-AGT-3’ |
Hoặc
|
Mồi |
Trình tự |
Sản phẩm |
|
273F |
5’-CAA-GAT-CTC-ACG-GCA-ACT-CA-3’ |
273 bp |
|
273R |
5’-CCG-ACG-AGA-GTG-TTA-GGA-GG-3’ |
Nồng độ của mồi sử dụng trong phân tích được pha loãng thành 25 mM trong dung dịch đệm TE. Ðệm TE có thành phần như sau: Tris-HCl 10 mM (pH 8,0) và EDTA 1 mM.
Khi sử dụng cặp mồi 273F/R, thành phần hóa chất cho phản ứng PCR cũng như điều kiện khuếch đại PCR xem Phụ lục B.
5.2 Thuốc thử tách chiết RNA
5.2.1 Dung dịch đệm ly giải/đệm liên kết mô
Dung dịch chứa guanidin-HCl 4,5 M, natri phosphat 100 mM, có pH 6,6. Bảo quản ở 25 0C.
5.2.2 DNaza I
Chuẩn bị dung dịch DNaza I gồm enzym DNaza 5 U/µl và dung dịch đệm rửa giải (5.2.6). Trộn kỹ, bảo quản ở –15 oC đến –25 oC.
5.2.3 Dung dịch đệm ủ DNaza
Dung dịch chứa NaCl 1 M, Tris-HCl 20 mM, MnCl2 10 mM, có pH 7,0. Bảo quản ở 25 oC.
5.2.4 Dung dịch đệm rửa I
Chuẩn bị dung dịch chứa guanidin-HCl 5 M và Tris-HCl 20 mM, có pH 6,6. Thêm vào 20 ml etanol tinh khiết. Bảo quản ở 25 oC.
5.2.5 Dung dịch đệm rửa II
Chuẩn bị dung dịch chứa NaCl 20 mM, Tris-HCl 2 mM, có pH 7,5. Thêm vào 40 ml etanol tinh khiết Bảo quản ở 25 oC.
5.2.6 Dung dịch đệm rửa giải: nước cất hai lần.
CHÚ THÍCH Có nhiều quy trình khác nhau để tách chiết RNA từ mô động vật. Tuy nhiên để đạt được kết quả mong muốn có thể sử dụng một số bộ chế phẩm tách chiết RNA thương mại có bán sẵn.
Nên sử dụng thuốc thử và các sản phẩm dùng cho phản ứng khuếch đại PCR được tổng hợp thành bộ chế phẩm đang được lưu hành trên thị trường có thành phần phù hợp như trên.
5.3 Pha chế dung dịch đệm TE (dùng để pha loãng cặn RNA)
Hòa tan Tris 10 mM với EDTA 1 mM, chỉnh pH về giá trị 7,6 bằng dung dịch HCl.
5.4 Hỗn hợp phản ứng khuếch đại PCR (Master mix)
Có thể sử dụng hỗn hợp phản ứng PCR được cung cấp sẵn trên thị trường.
5.5 Thang DNA
Sử dụng thang đo phù hợp có thể ước lượng được đoạn khuếch đại 135 bp hoặc 273 bp. Có thể sử dụng sản phẩm khuếch đại có kích thước 135 bp hoặc 273 bp đã biết trước.
5.6 Pha chế một số hoá chất điện di
5.6.1 Dung dịch đệm TBE đậm đặc 10 lần (Tris - axit boric - EDTA đậm đặc 10 lần)
Hòa tan 108 g Tris và 55 g axit boric trong 600 ml nước. Sau đó, thêm 40 ml EDTA 0,5 M và thêm nước cho đủ 1 l. Hấp vô trùng ở 121 oC trong 15 min. Bảo quản ở nhiệt độ phòng. Khi sử dụng mới pha loãng với nước cất vô trùng thành dung dịch đậm đặc 0,5 lần.
5.6.2 EDTA (etylen diamin tetra axetic) 0,5 M
Hòa tan 93,05 g EDTA trong 350 ml nước rồi chỉnh cho dung dịch có pH 8,0 bằng dung dịch NaOH nồng độ 4 M. Sau đó, thêm nước cất cho đủ 500 ml. Tiến hành hấp vô trùng và bảo quản ở nhiệt độ phòng.
5.6.3 Dung dịch đệm tải mẫu DNA đậm đặc 6 lần
Hoà tan các thành phần: Tris-HCl 10 mM (pH 7,6); bromophenol blue 0,03 %; xylen xyanol FF 0,03 %; glycerol 60 % và EDTA 60 mM.
5.6.4 Dung dịch diethypyrocarbonat (DEPC)
Trộn 0,1 % (phần thể tích) dietypyrocarbonat vào nước, lắc khoảng 10 min. Sau đó để qua đêm trong bình kín, nới lỏng nắp và hấp khử trùng ở 121 0C trong 15 min.
5.6.5 Tạo bảng thạch 1,5 % (Gel agaroza 1,5 %)
5.6.5.1 Tạo bảng thạch 1,5 %
Đun tan hoàn toàn 1,5 g agaroza trong 100 ml dung dịch đệm TBE đậm đặc 0,5 lần. Để nguội ở nhiệt độ phòng khoảng 10 min (đạt 55 °C đến 60 °C).
5.6.5.2 Dung dịch etidi bromua nồng độ 10 mg/ml
5.6.5.3 Nhuộm trong
Chuyển agaroza vừa đun vào một chai chuyên dùng để pha etidi bromua, sau đó cho vào 4ml etidi bromua 10 mg/ml (cho 4 ml etidi bromua 10 mg/ml vào 100 ml dung dịch agaroza), trộn đều (tránh tạo bọt khí). Chuẩn bị khuôn, cân bằng mặt khuôn bằng giọt nước, gắn lược vào khuôn, sau đó đổ agaroza vào khuôn đạt độ dày khoảng 3 mm đến 5 mm. Để đông tự nhiên ở nhiệt độ phòng. Gỡ lược, đặt bảng thạch vào trong máng điện di, các giếng của bảng thạch phải ở phía gần điện cực âm. Đổ dung dịch TBE đậm đặc 0,5 lần cho đến khi ngập bảng thạch trước khi cho mẫu vào để điện di.
5.6.5.4 Nhuộm ngoài
Sau khi điện di, ngâm bảng thạch vào dung dịch etidi bromua 10 mg/ml (5 µl hoà tan trong 100ml nước cất). Dung dịch này phải bao phủ toàn bộ bảng thạch. Lắc nhẹ trong khoảng 20 min. Sau đó, vớt bảng thạch ra khỏi dung dịch nhuộm, rửa với nước cất trong 10 min để loại bỏ dung dịch nhuộm còn dư trên bề mặt bảng thạch.
6. Thiết bị và dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm vi sinh thông thường và cụ thể như sau:
6.1 Bộ nghiền mẫu vô trùng.
6.2 Máy ly tâm, có thể hoạt động với tốc độ tối đa trên 12 000 r/min.
6.3 Máy luân nhiệt.
6.4 Bộ điện di, gồm nguồn và buồng điện di.
6.5 Bàn đọc kết quả, với tia UV bước sóng 302 nm, hoặc bộ phận chụp ảnh để lưu kết quả.
6.6 Micropipet, dung tích 10 µl; 20 µl; 100 µl; 1000 µl.
6.7 Ống nghiệm đáy côn (ống Eppendorf), dung tích 1,5 ml và 0,2 ml.
6.8 Ðầu típ các loại, có đầu lọc với thể tích không lớn hơn 10 µl.
6.9 Khuôn, khay, lược dùng để tạo bảng thạch.
6.10 Ống lọc tinh, có 2 lớp màng lọc, có thể chứa 700 µl dịch mẫu.
6.11 Ống góp, dùng bọc ngoài ống lọc tinh.
7. Cách tiến hành
7.1 Chuẩn bị mẫu
7.1.1 Đối với mẫu tôm hậu ấu trùng
Lượng mẫu dùng cho mỗi phản ứng từ 10 cá thể đến 30 cá thể. Đối với tôm hậu ấu trùng 11 ngày tuổi trở lên loại bỏ đầu.
7.1.2 Đối với mẫu tôm bố mẹ
Lượng mẫu dùng cho mỗi phản ứng từ 100 mg đến 200 mg cuống mắt hoặc một phần chân bơi.
7.1.3 Đối với mẫu tôm thương phẩm
Lượng mẫu dùng cho mỗi phản ứng từ 100 mg đến 200 mg phiến mang tôm, chân bơi, chân bò, cơ hoặc khoảng 100 µl dịch bạch huyết của tôm.
7.1.4 Yêu cầu đối với mẫu để phân tích
Mẫu tôm còn sống và bảo quản trong cồn 95 % ngay sau khi lấy. Thể tích cồn sử dụng để bảo quản không nên nhỏ hơn 3 lần thể tích mẫu cần phân tích. Sau khi cố định, mẫu được lưu giữ ở nhiệt độ từ 25 0C đến 30 0C trong 1 tuần. Khi cần bảo quản mẫu lâu hơn nữa phải thay cồn mới.
7.2 Tách chiết RNA
7.2.1 Cho khoảng 100 mg đến 200 mg mẫu tôm (7.1) vào ống nghiệm có đáy côn có thể tích 1,5 ml (Eppendorf), thêm 400 µl dung dịch tách chiết RNA (5.2.1).
7.2.2 Nghiền mẫu bằng chày nghiền vô trùng, ly tâm lạnh với tốc độ 13 000 r/min trong 2 min, sử dụng phần dịch nổi phía trên.
7.2.3 Bổ sung 200 µl etanol tinh khiết vào dịch nổi thu được, trộn đều.
7.2.4 Chuyển toàn bộ phần dịch nổi thu được (thể tích tối đa 700 µl) sang các ống lọc tinh có gắn ống góp.
7.2.5 Ly tâm lạnh với tốc độ 13 000 r/min trong 30 s.
7.2.6 Bỏ ống góp chứa phần dung dịch thu được và thay thế bằng ống góp mới.
7.2.7 Thêm 90 µl dung dịch đệm ủ DNaza (5.2.3) và 10 µl DNaza I (5.2.2) vào các ống lọc tinh, ủ 15 min ở nhiệt độ phòng.
7.2.8 Thêm 500 µl dung dịch đệm rửa I (5.2.4) vào các ống lọc tinh, ly tâm các ống với tốc độ 8 000 r/min trong 15 s, bỏ ống góp chứa phần dung dịch thu được và thay thế bằng ống góp mới.
7.2.9 Bổ sung 500 µl dung dịch đệm rửa II (5.2.5) vào các ống lọc tinh, ly tâm các ống với tốc độ 8 000 r/min trong 15 s, bỏ ống góp chứa phần dung dịch thu được và thay thế bằng ống góp mới.
7.2.10 Thêm 300 µl dung dịch đệm rửa II (5.2.5) vào các ống lọc tinh, ly tâm các ống với tốc độ 13 000 r/min trong 2 min, bỏ ống góp chứa phần dung dịch thu được và thay thế bằng ống góp mới.
7.2.11 Gắn các ống lọc tinh vào một ống nghiệm có đáy côn 1,5 ml khác.
7.2.12 Bổ sung 100 µl dung dịch đệm rửa (5.2.6) vào các ống lọc tinh, ly tâm các ống với tốc độ 8 000 r/min trong 1 min. Loại bỏ các ống lọc tinh, sản phẩm RNA được chứa trong các ống nghiệm có đáy côn 1,5 ml.
Sử dụng phần dịch RNA thu được để chạy RT-PCR hoặc giữ lạnh ở –20 oC chờ thực hiện bước kế tiếp.
7.3 Khuếch đại RNA bằng kỹ thuật RT-PCR
Để đảm bảo kết quả phân tích có độ tin cậy cao nên quá trình khuếch đại RNA cần chuẩn bị đầy đủ các yếu tố sau:
a) RNA của mẫu đã biết trước không có virut YHV;
b) RNA của mẫu đã biết trước dương tính YHV (bao gồm mẫu mô, máu hoặc plasmid); RNA mẫu trắng (nước cất hai lần).
Phản ứng PCR gồm phiên mã ngược một đoạn RNA thành cDNA, sau đó khuếch đại đoạn cDNA của YHV dựa trên các cặp mồi đặc hiệu (5.1).
7.3.1 Phiên mã ngược RNA thành cDNA
Cho 2 µl RNA ly trích từ mẫu vào 20 µl dung dịch đệm PCR (Tris/HCl 10 mM, có pH 8,3, KCl 50 mM) chứa 2,5 U enzym phiên mã ngược M-MLV (Moloney murine leukaemia virus), 1,0 U chất ức chế ribonucleaza, mồi ngược 0,75 μM (144R), dATP 1 mM, dTTP 1 mM, dCTP 1 mM, dGTP 1 mM và MgCl2 5 mM. Sau đó đem ủ ở 42 0C trong 15 min để tổng hợp thành cDNA. Tiếp tục ủ hỗn hợp ở 100 0C trong 5 min để làm bất hoạt enzym phiên mã ngược. Sau đó có thể làm lạnh về 5 0C để chờ phân tích các bước tiếp theo.
7.3.1.1 Mẫu thử
2 µl dịch chiết RNA cho vào một ống chứa hỗn hợp phản ứng RT-PCR (5.4).
7.3.1.2 Mẫu kiểm chứng dương tính
2 µl mẫu kiểm chứng dương tính cho vào một ống chứa hỗn hợp phản ứng RT-PCR (5.4).
7.3.1.3 Mẫu kiểm chứng âm tính
2 µl mẫu kiểm chứng âm tính cho vào một ống chứa hỗn hợp phản ứng RT-PCR (5.4).
7.3.2 Khuếch đại cDNA
Thêm vào hỗn hợp đã phiên mã ngược RNA thành cDNA 78 ml dung dịch đệm PCR (Tris-HCl 10 mM, có pH 8,3, KCl 50 mM) chứa 2,5 U Taq DNA polymeraza, MgCl2 2 mM và mồi xuôi 0,75 μM (10F).
7.3.3 Khuếch đại phản ứng PCR
Sau khi cho dịch tách chiết mẫu, mẫu kiểm chứng dương tính, mẫu kiểm chứng âm tính vào ống chứa hỗn hợp phản ứng PCR đã được đánh dấu, đậy nắp ống thật chặt, ly tâm nhẹ để dung dịch tụ hết xuống đáy ống không còn dính trên thành ống. Đặt các ống phản ứng PCR vào máy luân nhiệt thực hiện phản ứng theo chương trình sau:
|
Số chu kỳ |
Nhiệt độ, oC |
Thời gian |
|
40 |
94 |
30 s |
|
58 |
30 s |
|
|
72 |
30 s |
|
|
1 |
72 |
10 min |
Giữ ở 4 oC cho đến khi phân tích.
7.4 Điện di
7.4.1 Cho từ 5 µl đến 7 µl dung dịch đệm tải mẫu (5.6.3) vào các ống sản phẩm khuếch đại (7.3.3), trộn đều.
7.4.2 Hút khoảng 5 ml đến 7 ml từ các ống (7.4.1): mẫu kiểm chứng âm tính, mẫu kiểm chứng dương tính, thang DNA chuẩn, các mẫu vào mỗi giếng trên bảng thạch. Trình tự hút mẫu cho vào giếng: mẫu kiểm chứng âm tính, mẫu thử, mẫu kiểm chứng dương tính, thang DNA chuẩn.
7.4.3 Điện di ở hiệu điện thế 100 V đến 120 V. Sau khi nối điện, quan sát bong bóng khí từ hai phía của điện cực.
CHÚ THÍCH Dung dịch đệm tải mẫu gồm hai thành phần màu: màu xanh đậm là chỉ thị bromphenol blue; màu xanh nhạt là chỉ thị xylene cyanol. Khi quan sát thấy màu xanh đậm của thuốc nhuộm cách giếng khoảng 2/3 chiều dài bảng gel agaroza, dừng quá trình điện di.
Để đảm bảo kết quả phân tích có độ tin cậy cao, cần tiến hành điện di mẫu kiểm chứng âm tính, mẫu kiểm chứng dương tính, thang DNA chuẩn, mẫu phân tích.
7.4.4 Nhuộm etidi bromua bảng thạch (chỉ áp dụng cho nhuộm ngoài)
Xem 5.6.5.4.
7.5 Đọc kết quả
7.5.1 Đọc kết quả
7.5.1.1 Đọc kết quả bằng mắt thường
Đặt bảng gel vào máy đọc UV đã được lắp kính chắn. Bật đèn UV. Dưới ánh sáng của tia UV, các đoạn DNA có etidi bromua chèn giữa 2 mạch sẽ phát quang tạo thành vạch sáng.
7.5.1.2 Đọc kết quả bằng thiết bị chuyên dùng (Gel-Doc)
Để bảng thạch vào buồng đọc và đọc theo chương trình được cài sẵn trong máy tính.
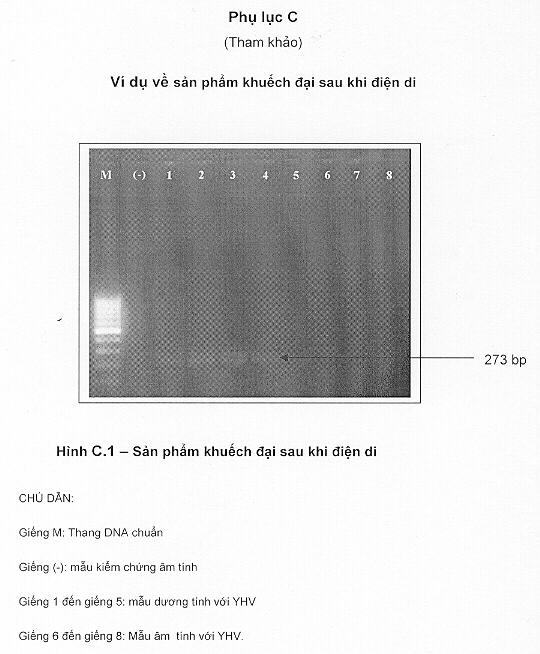
7.5.2 Đối chiếu các vạch sáng của mẫu với các vạch sáng từ chuẩn đối mẫu kiểm chứng dương tính, mẫu kiểm chứng âm tính và thang DNA để đưa ra kết luận.
7.5.3 Cách đọc kết quả
Đọc kết quả điện di theo trình tự như sau:
|
Kết quả điện di |
||
|
Giếng |
Vạch 135 bp |
Kết quả |
|
Thang DNA |
Phân vạch rõ ràng, sáng, theo kích thước của thang |
Điện di tốt |
|
Mẫu kiểm chứng dương tính [+] |
Có |
Hỗn hợp phản ứng PCR tốt |
|
Không |
Mẫu kiểm chứng dương tính hỏng, enzym hỏng |
|
|
Mẫu kiểm chứng âm tính [-] |
Không |
Không ngoại nhiễm |
|
Có |
Bị ngoại nhiễm |
|
|
Mẫu thử |
Có |
Có YHV |
|
Không |
Không có YHV |
|
8. Diễn giải kết quả
Theo phần diễn giải các kết quả, ghi lại phát hiện hoặc không phát hiện virut YHV trong phần mẫu thử.
8.1 Kết quả âm tính
Kết quả được coi là âm tính khi:
– phát hiện vạch sáng của mẫu kiểm chứng dương tính;
– không phát hiện vạch sáng của mẫu kiểm chứng âm tính;
– thang DNA phân vạch rõ ràng theo kích thước sử dụng.
– mẫu phân tích không có vạch DNA đích.
8.2 Kết quả dương tính
Kết quả được coi là dương tính:
– phát hiện vạch sáng của mẫu kiểm chứng dương tính;
– không phát hiện vạch sáng của mẫu kiểm chứng âm tính;
– thang DNA phân vạch rõ ràng theo kích thước sử dụng.
– mẫu phân tích xuất hiện vạch DNA đích.
8.3 Kết quả nghi ngờ
Khi thử nghiệm cho kết quả nghi ngờ (không phát hiện vạch sáng ở mẫu kiểm chứng dương tính, phát hiện vạch sáng của mẫu kiểm chứng âm tính hoặc thang DNA không phân vạch rõ ràng...), thì phải tiến hành phân tích lại.
9. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải ghi rõ:
– thông tin cần thiết để nhận biết đầy đủ về mẫu thử;
– phương pháp lấy mẫu đã sử dụng (nếu có);
– phương pháp thử sử dụng;
– chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc tùy ý lựa chọn, cùng với các chi tiết bất thường khác có thể ảnh hưởng tới kết quả (nếu có);
– kết quả thử nghiệm thu được;
– báo cáo kết quả cũng phải nêu rõ nếu các phép thử tiếp theo được thực hiện bởi phòng thử nghiệm chuẩn, hoặc nếu đã thực hiện thì nêu kết quả thu được.
Phụ lục B
(Tham khảo)
Thành phần cho phản ứng RT-PCR và điều kiện khuếch đại PCR khi sử dụng cặp mồi 273F/R
B.1 Thành phần cho phản ứng PCR
B.1.1 Thành phần
|
Thuốc thử |
25 ml /phản ứng |
Nồng độ cuối cùng |
|
Nước cất hai lần |
6,5 ml |
|
|
Dung dịch đệm EZ đậm đặc 5 lần |
5,0 ml |
Đậm đặc 1 lần |
|
Hỗn hợp dNTP (10 mM cho mỗi loại) |
3,0 ml |
300 mM cho mỗi loại |
|
Mồi 273F |
1,0 ml |
0,62 mM |
|
Mồi 273R |
1,0 ml |
0,62 mM |
|
Mn(OA)2 |
2,5 ml |
2,5 mM |
|
Enzyme rTth |
1,0 ml |
2,5 U |
|
Mẫu thử |
5,0 ml |
nhỏ hơn 50 ng |
B.1.2 Mẫu
5 µl dịch chiết RNA cho vào một ống chứa hỗn hợp phản ứng RT-PCR (B.1.1).
B.1.3 Mẫu kiểm chứng dương tính
5 µl mẫu kiểm chứng dương tính cho vào một ống chứa hỗn hợp phản ứng RT-PCR (B.1.1).
B.1.4 Mẫu kiểm chứng âm tính
5 µl mẫu kiểm chứng âm tính cho vào một ống chứa hỗn hợp phản ứng RT-PCR (B.1.1).
B.2 Khuếch đại PCR
Sau khi cho dịch tách chiết mẫu, mẫu kiểm chứng dương tính, mẫu kiểm chứng âm tính vào ống chứa hỗn hợp phản ứng PCR đã được đánh dấu, đậy nắp ống thật chặt, ly tâm nhẹ để dung dịch tụ hết xuống đáy ống không còn dính trên thành ống. Đặt các ống phản ứng PCR vào máy luân nhiệt thực hiện phản ứng theo chương trình sau:
|
Số chu kỳ |
Nhiệt độ, oC |
Thời gian |
|
1 |
60 |
30 min |
|
1 |
95 |
2 min |
|
39 |
95 |
45 s |
|
60 |
45 s |
|
|
72 |
45 s |
|
|
1 |
60 |
7 min |
Giữ ở 4 oC cho đến khi phân tích.