Tiêu chuẩn quốc gia TCVN 9514:2012 về Thực phẩm - Xác định vitamin B12 bằng phương pháp sắc ký lỏng hiệu năng cao (HPLC) đã được thay thế bởi Tiêu chuẩn quốc gia TCVN 9514:2017 (ISO 20634:2015) về Thức ăn công thức dành cho trẻ sơ sinh và thực phẩm dinh dưỡng cho người lớn - Xác định vitamin B12 bằng sắc kí lỏng hiệu năng cao pha đảo (RP-HPLC) .
Nội dung toàn văn Tiêu chuẩn quốc gia TCVN 9514:2012 về Thực phẩm - Xác định vitamin B12 bằng phương pháp sắc ký lỏng hiệu năng cao (HPLC)
TIÊU CHUẨN QUỐC GIA
TCVN 9514:2012
THỰC PHẨM - XÁC ĐỊNH VITAMIN B12 BẰNG PHƯƠNG PHÁP SẮC KÍ LỎNG HIỆU NĂNG CAO (HPLC)
Foodstuffs - Determination of vitamin B12 by high performance liquid chromatography (HPLC)
Lời nói đầu
TCVN 9514:2012 được xây dựng trên cơ sở AOAC 2011.10 Vitamin B12 in infant formula and adult nutritionals. High-performance liquid chromatography;
TCVN 9514:2012 do Ban kỹ thuật tiêu chuẩn quốc gia TCVN/TC/F13 Phương pháp phân tích và lấy mẫu biên soạn, Tổng cục Tiêu chuẩn Đo lường Chất lượng đề nghị, Bộ Khoa học và Công nghệ công bố.
THỰC PHẨM - XÁC ĐỊNH VITAMIN B12 BẰNG PHƯƠNG PHÁP SẮC KÍ LỎNG HIỆU NĂNG CAO (HPLC)
Foodstuffs - Determination of vitamin B12 by high performance liquid chromatography (HPLC)
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp xác định hàm lượng vitamin B12 trong thực phẩm bằng sắc kí lỏng hiệu năng cao (HPLC).
Phương pháp này đã được đánh giá xác nhận trên các mẫu thức ăn công thức cho trẻ sơ sinh và sản phẩm bổ sung vitamin B12 dành cho người lớn. Để có thêm thông tin về các dữ liệu đã được đánh giá xác nhận ở trên, xem Phụ lục A.
2. Nguyên tắc
Vitamin B12 được chiết ra khỏi mẫu thử bằng dung dịch đệm natri axetat (pH 4,5) và kali xyanua ở 105 oC. Dịch chiết được tinh sạch và cô đặc bằng cột chiết pha rắn (SPE) C8 hoặc C18, sau đó được phân tích bằng sắc kí rây phân tử và sắc kí pha đảo. Vitamin B12 được xác định bằng sắc kí lỏng với detector khả kiến ở bước sóng 550 nm.
3. Thuốc thử
Chỉ sử dụng thuốc thử loại tinh khiết phân tích và chỉ sử dụng nước có điện trở suất không nhỏ hơn 15 MW cm, trừ khi có quy định khác.
3.1 Axetonitril, loại dùng cho HPLC.
3.2 Canxi sulfat, khan, cỡ hạt 8 mesh, sử dụng làm chất hút ẩm, ví dụ Drierite 1).
3.3 Dung dịch etanol, 25%
Pha loãng 50 ml etanol bằng nước đến 200ml.
3.4 Dung dịch đệm natri axetat, 0,1 M
Hòa tan 16,4 g natri axetat khan hoặc 27,2 g natri axetat ngậm ba phân tử nước trong khoảng 1800 ml nước. Chỉnh pH đến 4,50 bằng axit axetic đậm đặc. Pha loãng bằng nước đến 2 000 ml.
Dung dịch đã pha có thể sử dụng trong vòng 3 tháng.
3.5 Dung dịch kali xyanua, 0,4%
Hòa tan 0,02 g kali xyanua (độ tinh khiết ³ 97 %) trong dung dịch đệm natri axetat 0,1 M (3.4) và pha loãng đến 5 ml.
Chuẩn bị dung dịch ngay trước khi sử dụng.
3.6 Dung dịch kali xyanua, 1%
Hòa tan 0,25 g kali xyanua (độ tinh khiết ³ 97 %) trong nước và pha loãng đến 25 ml.
Chuẩn bị dung dịch ngay trước khi sử dụng.
3.7 Dung dịch Taka-diastaza, 6%
Hòa tan 0,6g Taka-diastaza2) trong 10 ml nước. Chuẩn bị dung dịch ngay trước khi sử dụng.
3.8 Dung môi pha động A
Pha loãng 4,0 ml trietylamin (TEA) bằng nước đến 1 000 ml và chỉnh pH đến giá trị từ 5 đến 7 bằng axit formic đậm đặc.
3.9 Dung môi pha động B
Chuyển 4,0 ml TEA vào 250 ml axetonitril, pha loãng bằng nước đến 1 000 ml và chỉnh pH đến giá trị từ 5 đến 7 bằng axit formic đậm đặc.
3.10 Dung môi pha động C
Chuyển 4,0 ml TEA vào 750 ml axetonitril, pha loãng bằng nước đến 1 000 ml và chỉnh pH đến giá trị từ 5 đến 7 bằng axit formic đậm đặc.
3.11 Dung dịch axetonitril trong nước, 2,5% (dung môi pha động D)
Pha loãng 50 ml axetonitril bằng nước đến 2 000 ml.
3.12 Dung dịch axetonitril trong nước, 10%
Pha loãng 150 ml axetonitril bằng nước đến 1 500 ml.
3.13 Dung dịch axetonitril trong nước, 25% (dung môi rửa giải SPE)
Pha loãng 25 ml axetonitril bằng nước đến 100 ml.
3.14 Dung dịch axetonitril trong nước, 30% (dung môi rửa giải SPE)
Pha loãng 30 ml axetonitril bằng nước đến 100 ml.
3.15 Dung dịch axetonitril trong nước, 50% (dung môi bảo quản và làm sạch cột)
Pha loãng 500 ml axetonitril bằng nước đến 1 000 ml. Dung dịch đã pha có thể sử dụng trong 6 tháng.
3.16 Dung dịch chuẩn vitamin B12
Chuẩn bị các dung dịch chuẩn tại nơi tránh được ánh sáng UV. Bảo quản các dung dịch chuẩn ở nhiệt độ từ 2 oC đến 8 oC trong bình định mức có nắp đậy kín khí.
3.16.1 Dung dịch chuẩn gốc vitamin B12, 10 000 mg/l
Cân chính xác khoảng 1 mg chất chuẩn vitamin B12 (khối lượng cân phụ thuộc vào độ chính xác của chất chuẩn). Hòa tan trong etanol 25 % (3.3) và pha loãng bằng etanol 25 % đến 100 ml. Dung dịch đã pha có thể sử dụng trong 6 tháng.
Khối lượng chất chuẩn vitamin B12 cần lấy, Sw, tính bằng miligam (mg), được tính như sau:
Sw = 10 000 x 0,1 x 1/P
Trong đó:
10 000 là nồng độ cần đạt của dung dịch chuẩn gốc, tính bằng microgam trên lít (mg/l);
0,1 là thể tích pha loãng, tính bằng lít (l);
P là độ tinh khiết của chất chuẩn vitamin B12, biểu thị theo cyanocobalamin, tính bằng microgam trên miligam (mg/mg).
3.16.2 Dung dịch chuẩn trung gian vitamin B12, 1 000 mg/l
Pha loãng 10 ml dung dịch chuẩn gốc vitamin B12 (3.16.1) bằng nước đến 100 ml. Dung dịch đã pha bền trong 1 tuần.
3.16.3 Dung dịch chuẩn làm việc vitamin B12, từ 2,5 mg/l đến 25 mg/l
Pha loãng 0,5; 1; 2; 3; 4 và 5 ml dung dịch chuẩn trung gian vitamin B12 (3.16.2) bằng axetonitril 10 % (3.12) đến 200 ml. Dung dịch đã pha bền trong 1 tháng.
4. Thiết bị, dụng cụ
Sử dụng các thiết bị, dụng cụ của phòng thử nghiệm thông thường và cụ thể như sau:
4.1 Hệ thống HPLC
Hệ gradient với khóa đổi chiều, bơm đẳng dòng và detector UV-VIS được trang bị đèn volfram, có thể hoạt động ở bước sóng 550nm và có bộ lấy mẫu tự động có thể bơm 2 ml mẫu.
4.2 Cột rây phân tử
Cột có cỡ hạt 4 mm, kích thước 250 mm x 9,4 mm 3) hoặc cỡ hạt 5 mm, kích thước 300 mm x 8 mm 4) hoặc tương đương.
4.3 Cột phân tích pha đảo
Cột phân tích C18, loại có cỡ hạt 3 mm, kích thước 100 mm x 4,6 mm 5) với cột bảo vệ có cỡ hạt 3 mm, kích thước 10 mm x 4,6 mm 6) hoặc loại tương đương.
4.4 Tủ sấy, có thể duy trì nhiệt độ ở (95 ± 5) oC và (105 ± 5) oC.
4.5 Dụng cụ đo pH.
4.6 Cân phân tích, có thể cân chính xác đến 0,01 mg.
4.7 Xyranh, loại dùng một lần, dung tích 30 ml.
4.8 Bình nón, dung tích 125 ml.
4.9 Bình định mức, dung tích 5 ml, 10 ml và 100 ml.
4.10 Giấy lọc, Whatman 2V hoặc loại tương đương.
4.11 Phễu lọc, bằng chất dẻo, thích hợp để sử dụng cùng giấy lọc.
4.12 Pipet.
4.13 Cột SPE
Cột C8, 600 mg 7); C8, 900 mg 8); C18, 600mg 9); C18, 900mg 10) hoặc loại tương đương.
4.14 Màng lọc, bằng nylon cỡ lỗ 0,45 mm.
4.15 Bộ chân không, 24 cổng, có van khóa, hoặc loại tương đương.
4.16 Lọ đựng mẫu.
4.17 Tủ hút
5. Lấy mẫu
Việc lấy mẫu không quy định trong tiêu chuẩn này.
Mẫu gửi đến phòng thí nghiệm phải là mẫu đại diện. Mẫu không được hư hỏng hoặc thay đổi trong suốt quá trình bảo quản và vận chuyển.
6. Cách tiến hành
6.1 Chuẩn bị mẫu thử
Thực hiện chuẩn bị mẫu thử trong điều kiện tránh ánh sáng UV. Bảo quản mẫu thử đã chuẩn bị ở nhiệt độ từ 2 oC đến 8 oC và sử dụng trong vòng 14 ngày.
Trộn kỹ và đồng hóa mẫu thử. Cân một lượng mẫu thử thích hợp (khoảng 20 g đến 30 g mẫu thử dạng lỏng hoặc khoảng 3 g mẫu thử dạng bột), cho vào bình định mức 100 ml (4.9). Thêm 25 ml nước đối với phần mẫu thử dạng bột và trộn kỹ.
Thêm 1 ml dung dịch taka-diastaza 6 % (3.7) nếu mẫu có chứa hàm lượng tinh bột đáng kể. Để cho taka-diastaza phản ứng với mẫu trong ít nhất 30 min trước khi tiếp tục chiết mẫu theo 6.2.
6.2 Chiết mẫu
Thêm 30 ml dung dịch đệm natri axetat 0,1 M (3.4) vào mỗi phần mẫu thử và lắc bình để trộn. Đưa bình vào tủ hút (4.17), thêm 1 ml dung dịch kali xyanua 1 % (3.6) mới chuẩn bị vào mỗi bình và lắc bình để trộn.
Đun nóng mẫu ở nhiệt độ 105 oC trong tủ sấy (4.4) ít nhất 60 min và không quá 120 min (nhiệt độ tủ sấy giảm mỗi khi mở cửa tủ, thời gian đun được tiếp tục tính khi tủ sấy đạt nhiệt độ 105 oC). Sau đó, lấy mẫu ra và làm nguội ngay trong bể nước đá.
Pha loãng mẫu bằng nước đến vạch 100 ml. Trộn kỹ.
Lọc mẫu qua giấy lọc (4.10) vào bình nón dung tích 125 ml (4.8) hoặc dụng cụ thủy tinh tương đương.
CHÚ THÍCH: Nếu phần mẫu thử có chứa sữa và chứa một lượng nhỏ các hạt không hòa tan thì ly tâm mẫu và chuyển lớp chất lỏng vào phễu (4.11) qua giấy lọc (4.10).
6.3 Cô đặc mẫu
Với mỗi phần mẫu thử cần làm sạch và cô đặc, đưa cột SPE (4.13) qua vòi khóa của bộ chân không (4.15) và lắp thân xyranh dùng một lần dung tích 30 ml (4.7) vào đỉnh cột SPE. Thông thường, cột C8 hoặc C18 loại 600 mg đủ dung tích cho hầu hết các sản phẩm nhưng nếu mẫu thực phẩm ăn liền chứa hàm lượng protein cao (lớn hơn 5 %) hoặc hàm lượng protein thủy phân cao (lớn hơn 4 %) thì cần dùng cột C8 hoặc C18 loại 900 mg.
CHÚ THÍCH: Các cột C8 và C18 có thể sử dụng hoán đổi nhau.
Ổn định cột bằng ít nhất 20 ml axetonitril (3.1) và tráng mỗi cột bằng ít nhất 10 ml nước.
Dùng pipet (4.12) chuyển dịch lọc lên cột theo quy định trong Bảng 1. Có thể sử dụng chân không để dung dịch mẫu dàn đều trên toàn bộ cột. Loại bỏ dịch rửa giải.
Bảng 1 - Thể tích dịch lọc được tải lên cột SPE theo nồng độ vitamin B12 dự kiến a)
|
Nồng độ vitamin B12 dự kiến, mg/l |
Thể tích dịch lọc được tải lên cột SPE, ml |
Thể tích pha loãng cuối cùng, ml |
|
Nhỏ hơn 1 |
80 |
5 |
|
Từ 1 đến 10 |
Từ 70 đến 80 |
10 |
|
Từ 11 đến 20 |
Từ 50 đến 60 |
10 |
|
Từ 21 đến 50 |
Từ 20 đến 40 |
10 |
|
a) Không sử dụng nhiều hơn 60 ml sản phẩm dinh dưỡng bổ sung vitamin B12 dùng cho người lớn lên cột C8 hoặc C18. |
||
Sau khi toàn bộ dịch lọc chảy qua cột SPE, tráng cột bằng 5 ml nước và loại bỏ dịch rửa giải. Làm khô cột bằng cách hút chân không đến khi không còn dịch rửa giải chảy ra rồi khóa van.
Đặt bình định mức 5 ml hoặc 10 ml (4.9) phía dưới cột. Thêm 4,4 ml axetonitril 25 % (3.13) vào các cột SPE 600 mg và 4,4 ml axetonitril 30 % (3.14) vào các cột SPE 900 mg. Mở van khóa và cho nước rửa giải vitamin B12 vào các bình định mức.
Sự pha loãng cuối cùng là:
Đối với dịch lọc mẫu đựng trong bình định mức 10 ml, pha loãng bằng nước đến vạch.
Đối với dịch lọc mẫu đựng trong bình định mức 5 ml, đưa vào tủ hút (4.17) và thêm 0,1 ml dung dịch kali xyanua 0,4 % (3.5) mới chuẩn bị.
Đặt các bình định mức vào tủ sấy (4.4) ở 95 oC trong ít nhất 1,5 h và không quá 4h, sau đó lấy bình ra và làm nguội đến nhiệt độ phòng. Pha loãng bằng nước đến vạch. Lọc các lượng chứa trong bình định mức qua màng lọc 0,45 mm (4.14) vào lọ đựng mẫu (4.16).
6.4 Phân tích bằng HPLC
6.4.1 Cài đặt hệ thống
Cài đặt cấu hình của hệ thống theo Hình 1 và Hình 2.

|
Hình 1 - Cấu hình 1 |
Hình 2 - Cấu hình 2 |
6.4.2 Điều kiện vận hành thiết bị
a) Thời gian chạy: 30 min;
b) Thể tích bơm: 2,0 ml;
c) Cấu hình của hệ thống: theo quy định trong Bảng 2.
Bảng 2 - Cấu hình của hệ thống
|
Thời gian, min |
Cấu hình của van |
|
Từ 0,0 đến 10,5 |
Cấu hình 1 |
|
Từ 10,5 đến 14,5 |
Cấu hình 2 |
|
Từ 14,5 đến 30,0 |
Cấu hình 1 |
d) Bơm đẳng dòng
- pha động D: Dung dịch axetonitril 2,5 % (3.11);
- tốc độ dòng: điển hình từ 1,1 ml/min đến 1,2 ml/min; điều chỉnh sao cho dịch rửa giải vitamin B12 chảy từ cột rây phân tử trong thời gian từ 10,5 min đến 14,5 min.
CHÚ THÍCH: Để xác định tốc độ dòng thích hợp, nối trực tiếp cột rây phân tử với detector UV-Vis và bơm dung dịch chuẩn đi qua. Chỉnh tốc độ dòng sao cho dịch rửa giải vitamin B12 chảy từ cột rây phân tử trong thời gian từ 10,5 min đến 14,5 min.
e) Bơm gradient
Thành phần dung môi pha động:
- dung môi pha động A (3.8);
- dung môi pha động B (3.9);
- dung môi pha động C (3.10).
Gradient để rửa giải vitamin B12 trong 20 min đến 25 min: xem Bảng 3.
Bảng 3 - Gradient của cột C18
|
Thời gian, min |
Pha động, % |
||
|
A |
B |
C |
|
|
0,00 |
90 |
10 |
0 |
|
14,5 |
90 |
10 |
0 |
|
14,6 |
41 |
59 |
0 |
|
26,0 |
41 |
59 |
0 |
|
26,1 |
0 |
10 |
90 |
|
28,0 |
0 |
10 |
90 |
Tốc độ dòng: 1,0 ml/min.
f) Cài đặt detector
- bước sóng phát hiện: 550nm;
- băng thông: 10 nm.
6.4.3 Vận hành HPLC
Bơm dung dịch chuẩn làm việc (3.16.3) từ 3 lần đến 4 lần, độ chính xác của mỗi lần bơm £ 3 %.
Nếu hệ thống hoạt động tốt, bơm lần lượt một dãy từ 3 đến 6 dung dịch chuẩn làm việc (3.16.3), một mẫu kiểm soát, một dãy từ 1 đến 14 dung dịch mẫu thử và một dãy từ 3 đến 6 dung dịch chuẩn làm việc khác. Mỗi dãy dung dịch mẫu thử cần được sắp xếp tương ứng với các dung dịch chuẩn có nồng độ thích hợp.
6.5 Dựng đường chuẩn
Với mỗi nồng độ chất chuẩn, tính giá trị trung bình của diện tích pic của chất chuẩn được bơm đầu tiên và diện tích pic của chất chuẩn được bơm cuối cùng trong dãy mẫu. Dựng đường chuẩn tuyến tính bằng phương pháp bình phương nhỏ nhất của nồng độ chất chuẩn theo diện tích pic trung bình của các dung dịch chuẩn làm việc.
Đường chuẩn phải có hệ số tương quan ít nhất là 0,999.
Với mỗi nồng độ của dung dịch chuẩn làm việc, diện tích pic của chất chuẩn được bơm đầu tiên và diện tích pic của chất chuẩn được bơm cuối cùng không được dao động quá 10 %.
7. Tính kết quả
Kiểm tra sắc kí đồ của dung dịch chuẩn và dung dịch mẫu thử và kiểm tra độ phân giải của vitamin B12 của các pic trên sắc kí đồ (xem Phụ lục A).
Tính diện tích pic vitamin B12. Cần đảm bảo rằng diện tích pic của dung dịch mẫu thử nằm trong dải diện tích pic của các dung dịch chuẩn làm việc.
Tính phần khối lượng của vitamin B12 trong mẫu thử, X, bằng microgram trên kilogam (mg/kg), theo công thức sau:
X = ![]()
Trong đó:
Ci là nồng độ vitamin B12 trong dung dịch mẫu thử được bơm vào thiết bị HPLC (xem 6.4.3), được xác định từ đường chuẩn, tính bằng microgram trên lít (mg/l);
D1 là thể tích dung dịch pha loãng thứ nhất, tính bằng mililit (D1 = 100 ml);
D2 là thể tích dung dịch pha loãng cuối cùng, tính bằng mililit (ml);
V là thể tích dịch lọc được đưa lên cột SPE, tính bằng mililit (ml);
w là khối lượng mẫu, tính bằng gam (g).
8. Báo cáo thử nghiệm
Báo cáo thử nghiệm phải bao gồm các thông tin sau:
a) mọi thông tin cần thiết về nhận biết đầy đủ về mẫu thử;
b) phương pháp lấy mẫu đã sử dụng, nếu biết;
c) phương pháp thử đã sử dụng, viện dẫn tiêu chuẩn này;
d) mọi chi tiết thao tác không quy định trong tiêu chuẩn này, hoặc được xem là tùy chọn, cùng với mọi tình huống bất thường có thể ảnh hưởng đến kết quả;
e) kết quả thử nghiệm thu được.
Phụ lục A
(Tham khảo)
Dữ liệu về kết quả đánh giá xác nhận phương pháp
Dữ liệu về kết quả đánh giá xác nhận phương pháp trên các nền mẫu thức ăn công thức cho trẻ sơ sinh và sản phẩm dinh dưỡng được nêu trong Bảng A.1
Bảng A.1 - Dữ liệu về kết quả đánh giá xác nhận phương pháp
|
Mẫu |
Phương pháp HPLC |
Giá trị trung bình của phương pháp vi sinh, mg/kg |
Tỉ lệ giá trị trung bình của phương pháp HPLC so với phương pháp vi sinh, % |
||
|
Số lượng mẫu |
Giá trị trung bình, mg/kg |
Độ lệch chuẩn tương đối, % |
|||
|
Thức ăn công thức không chứa chất gây dị ứng, dạng bột |
12 |
51,4 |
4,00 |
53,6 |
95,9 |
|
Thức ăn công thức từ đậu nành, dạng bột |
15 |
47,8 |
5,30 |
48,5 |
98,6 |
|
Thức ăn công thức năng lượng cao từ sữa, dạng bột |
12 |
59,5 |
5,19 |
61,2 |
97,2 |
|
Thức ăn công thức từ sữa, dạng lỏng |
9 |
4,30 |
4,42 |
4,20 |
102 |
|
Thức ăn công thức không chứa lactoza, dạng bột |
12 |
42,9 |
4,70 |
45,6 |
94,1 |
|
Thức ăn dinh dưỡng cho trẻ nhỏ |
9 |
7,04 |
5,27 |
7,80 |
90,2 |
|
Thức ăn dinh dưỡng cho người lớn |
12 |
51,7 |
5,66 |
47,6 |
109 |
|
Đồ uống dinh dưỡng cho người lớn |
21 |
11,2 |
4,85 |
10,8 |
104 |
|
Bột dinh dưỡng đã chuyển hóa, dành cho trẻ nhỏ/người lớn |
9 |
48,0 |
8,88 |
49,5 |
97,0 |
|
Đồ uống dinh dưỡng cho người lớn bị bệnh đái đường |
9 |
21,7 |
0,76 |
23,2 |
93,5 |
|
Bột dinh dưỡng đã chuyển hóa cho trẻ nhỏ/người lớn |
14 |
89,8 |
4,85 |
87,7 |
102 |
|
Đồ uống dinh dưỡng với mục đích chữa bệnh cho người lớn |
9 |
16,6 |
5,10 |
18,3 |
90,7 |
Phụ lục B
(Tham khảo)
Sắc kí đồ điển hình
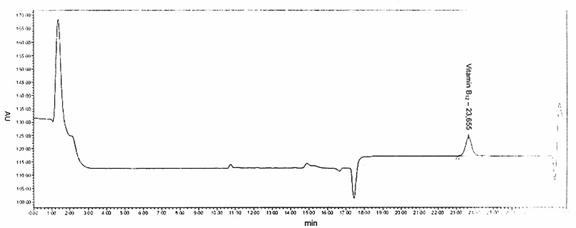
Hình B.1 - Ví dụ 1
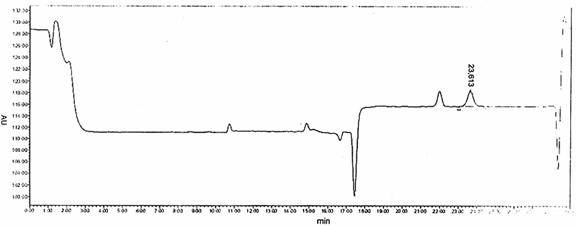
Hình B.2 - Ví dụ 2
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] Karen Schimpf, Renee Spiegel, and Linda Thompson: Determination of Vitamin B in Infant Formula and Adult Nutritionals by HPLC, J. AOAC International Vol. 95, No. 2, 2012
1) Tiêu chuẩn này không ấn định sử dụng sản phẩm này, có thể sử dụng các sản phẩm tương tự nếu cho kết quả tương đương.
2) Có thể sử dụng sản phẩm của Accurate Chemical Co. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
3) Có thể sử dụng sản phẩm Zorbax GF-250, P/N 884973-901. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
4) Có thể sử dụng sản phẩm Shodex Protein KW-802.5, P/N F6989000. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
5) Có thể sử dụng sản phẩm Thermo Scientific Aquasil P/N 77503-104630. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
6) Có thể sử dụng sản phẩm Thermo Scientific Aquasil P/N 77503-014001. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
7) Có thể sử dụng sản phẩm Alltech/Grace Davidson P/N 20958. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
8) Có thể sử dụng sản phẩm Alltech/Grace Davidson P/N 20966. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
9) Có thể sử dụng sản phẩm Alltech/Grace Davidson P/N 20934. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
10) Có thể sử dụng sản phẩm Alltech/Grace Davidson P/N 20942. Thông tin này đưa ra tạo thuận tiện cho người sử dụng tiêu chuẩn và không ấn định phải sử dụng chúng. Có thể sử dụng các sản phẩm tương tự nếu cho các kết quả tương đương.
