Nội dung toàn văn Tiêu chuẩn Việt Nam TCVN 6187-1:1996 (ISO 9308-1: 1990) về chất lượng nước - Phát hiện và đếm vi khuẩn coliform, vi khuẩn coliform chịu nhiệt và Escherichia coli giả định - Phần 1: Phương pháp màng lọc do Bộ Khoa học Công nghệ và Môi trường ban hành
TIÊU CHUẨN VIỆT NAM
TCVN 6187-1 : 1996
(ISO 9308-1: 1990)
CHẤT
LƯỢNG NƯỚC - PHÁT HIỆN VÀ ĐẾM VI KHUẨN COLIFORM, VI KHUẨN COLIFORM CHỊU NHIỆT
VÀ ESCHERICHIA COLI GIẢ ĐỊNH. PHẦN 1: PHƯƠNG PHÁP MÀNG LỌC
Water quality - Detection and enumeration of coliform organisms
thermotolerant coliform organisms and presumptive escherichiacoli. Part 1:
Membrane filtration method
Lời nói đầu
TCVN 6187-1: 1996 hoàn toàn tương đương với ISO 9308-1: 1990 (E)
TCVN 6187-1: 1996 do Tiểu ban kỹ thuật Nước tinh lọc
TCVN/TC/F9/SC1 thuộc Ban kỹ thuật tiêu chuẩn
TCVN/TC/F9 Đồ uống biên soạn, Tổng cục Tiêu chuẩn - Đo lường - Chất lượng đề nghị, Bộ Khoa học, Công nghệ và Môi trường ban hành.
CHẤT LƯỢNG NƯỚC - PHÁT HIỆN VÀ ĐẾM VI KHUẨN COLIFORM, VI KHUẨN COLIFORM CHỊU NHIỆT VÀ ESCHERICHIA COLI GIẢ ĐỊNH. PHẦN 1: PHƯƠNG PHÁP MÀNG LỌC
Water quality - Detection and enumeration of coliform organisms thermotolerant coliform organisms and presumptive escherichiacoli. Part 1: Membrane filtration method
1. Phạm vi áp dụng
Tiêu chuẩn này quy định phương pháp phát hiện và đếm vi khuẩn coliform, vi khuẩn coliform chịu nhiệt và escherichia coli giả định có trong nước sau khi lọc qua màng, tiếp theo nuôi cấy trong môi trường lactoza phân lập (xem ISO 7704) và tính toán số lượng của chúng có trong mẫu.
Phương pháp này có thể áp dụng cho tất cả các loại nước trừ nước có các chất lơ lủng gây ảnh hưởng đối với việc lọc hoặc có nhiều vi sinh vật khác có thể gây ảnh hưởng đối với việc sinh trưởng.
Việc lựa chọn các phép thử dùng để phát hiện và xácnhận các vi khuẩn nhóm coliform, kể cả E.coli có thể được xem như là một phần của dãy liên tiếp. Qui mô của việc xác nhận với một mẫu thử riêng biệt một phần tuỳ thuộc vào bản chất của mẫu nước, phần khác tuỳ thuộc vào mục đích của việc xét nghiệm. Trên thực tế việc phát hiện E.coli giả định nêu ở 3.3 thông thường để cung cấp một chứng cứ của sự mới bị nhiễm phân.
2. Tiêu chuẩn trích dẫn
- ISO 3696:1987 Nước dùng trong phòng thí nghiệm phân tích - Yêu cầu kỹ thuật và phương pháp thử.
- ISO 5667-1: 1980 Chất lượng nước- Lấy mẫu. Phần 1: Hướng dẫn các phương án lấy mẫu
- TCVN 5992: 1995 (ISO 5667-2: 1982 Chất lượng nước - Lấy mẫu - Hướng dẫn các kỹ thuật lấy mẫu)
- TCVN 5993: 1995 (ISO 5667-3: 1985) Chất lượng nước - Lấy mẫu. Hướng dẫn bảo quản và xử lý mẫu thử
- ISO 6887:1983 Chất lượng nước - Vi sinh vật học. Hướng dẫn chung về chuẩn bị các dung dịch pha loãng để kiểm tra vi sinh vật.
- ISO 7704:1985 Chất lượng nước- Đánh giá màng lọc dùng để phân tích vi sinh.
- ISO 8199:1980 Chất lượng nước- Hướng dẫn chung cách đếm vi sinh vật bằng cách nuôi cấy.
3. Định nghĩa
Với mục đích của tiêu chuẩn này, áp dụng các định nghĩa sau:
3.1 Vi khuẩn coliform - các sinh vật (vi khuẩn) có khả năng tạo thành các khuẩn lạc ở 350C ± 0,50C hoặc 370C ± 0,50C trong điều kiện hiếu khí trong một môi trường lactoza nuôi cấy chọn lọc kèm theo việc tạo thành axit (và andehyt) trong vòng 24 giờ.
3.2 Các vi khuẩn coliform chịu nhiệt: các vi khuẩn coliform như đã nêu ở mục 3.1 có cùng đặc tính lên men trong vòng 24 h, hoặc ở 440C ± 0,250C , hoặc ở 44,50C ± 0,250C .
Chú thích-
Do việc sinh khí không thể phát hiện thấy trên các màng lọc, nên cácvi khuẩn thu được bằng mànglọc không nhất thiết giống như khi phát hiện bằng phương pháp nhiều ống { có số xác xuất cao nhất (MPN)}
3.3 escherichia coli (E.coli giả định): các vi khuẩn coliform chịu nhiệt như mô tả trong 3.2 chúng cũng sinh khí từ lactoza (và manitol) cũng như sinh indol từ tryptophan trong vòng 24 giờ hoặc ở 440C ± 0,250C , hoặc ở 44,50C ± 0,250C .
4. Nguyên tắc
Lọc một lượng mẫu thử qua màng lọc để giữ lại các vi khuẩn, đặt màng lọc lên môi trường nuôi cấy thạch lactoza chọn lọc hoặc một miếng đệm hấp thụ bão hoà bằng môi trường lỏng chọn lọc chứa lactoza.
Nuôi cấy màng lọc trong 24 giờ ở nhiệt độ 350C hoặc 370C để phát hiện vi khuẩn coliform, hoặc ở 440C để phát hiện vi khuẩn coliform chịu nhiệt.
Đếm trực tiếp các khuẩn lạc đặc trưng được hình thành trên màng; Cấy kế tiếp một số các khuẩn lạc này để thử nghiệm xác nhận về việc sinh khí và indol. Tính toán số vi khuẩn coliform, coliform chịu nhiệt và E.coli giả định có trong 100 ml mẫu.
5. Môi trường nuôi cấy, pha loãng và thuốc thử
5.1 Các vật liệu chính
Sử dụng các thành phần với chất lượng đồng nhất và các hoá chất thuộc loại phân tích để chuẩn bị môi trường nuôi cấy và các thuốc thử và theo hướng dẫn trong phụ lục B.
Thông tin về bảo quản xem ISO 3199. Có thể thay thế bằng cách dùng môi trường hoàn toàn khô và phải tuân thủ nghiêm ngặt hướng dẫn của nhà sản xuất.
Để chuẩn bị môi trường, dùng nước cất bằng thiết bị cất nước bằng thuỷ tinh hoặc nước đã khử ion không chứa các chất có thể ức chế sự sinh trưởng của các vi sinh vật dưới điều kiện thử theo ISO 3696.
5.2 Dịch pha loãng
Nên dùng một trong các dung dịch trong phụ lục B để pha loãng mẫu.Chuẩn bị dịch pha loãng cần theo hướng dẫn ở phụ lục B.
5.3 Môi trường phân lập
Dùng một hoặc một số môi trường sau hoặc ở dạng rắn với thạch hoặc canh thang dùng để bão hoà chất đệm hấp thụ. Hướng dẫn để chuẩn bị môi trường theo phụ lục B.
5.3.1 Thạch lactoza TTC với Tegitol 7.
5.3.2 Thạch lactoza với Tegitol 7.
5.3.3 Canh thang Teepol làm giàu màng.
5.3.4 Canh thang lauryl sufat màng.
5.3.5 Môi trường Endo.
5.3.6 Thạch LES Endo.
5.3.7 Môi trường mFC.
5.4 Môi trường khẳng định
Dùng một hoặc một số môi trường sau.
5.4.1 Môi trường để kiểm tra sự sinh khí
Nước pepton lactoza.
5.4.2 Môi trường để kiểm tra sự sinh indol
Nước trypton.
5.4.3 Môi trường ống đơn để kiểm tra sinh khí và indol
Canh thang manitol lauryl trypto với tryptophan.
5.5 Thuốc thử
5.5.1 Thuốc thử kovac để thử indol
5.5.2 Thuốc thử oxidaza dùng cho phép thử oxidaza.
6. Thiết bị
Thiết bị phòng thí nghiệm vi sinh thông thường gồm:
6.1 Tủ sấy để khử trùng khô và một nồi hấp áp lực
Trừ các thiết bị đã được vô trùng sẵn, dụng cụ thuỷ tinh và các trang bị khác cần phải khử trùng theo chỉ dẫn đã nêu trong ISO 8199.
6.2 Tủ ấm hoặc nồi cách thuỷ kiểm tra được nhiệt độ ở 350C ± 0,50C hoặc ở 370C ± 0,50C .
6.3 Tủ ấm hoặc nồi cách thuỷ kiểm tra được nhiệt độ ở 440C ± 0,250C hoặc 44,50C ± 0,250C .
6.4 pH mét
6.5 Dụng cụ lọc màng
6.6 Màng lọc, thông thường có đường kính 47 mm hoặc 50 mm, có đặc tính lọc tương đương với lỗ có
đường kính danh định là 0,45 àm, nếu chưa được khử trùng thì phải khử trùng theo hướng dẫn của nhà sản xuất
6.7 Kẹp để giữ màng lọc
7. Lấy mẫu
Lấy mẫu và chuyển về phòng thí nghiệm theo ISO 8199, ISO 5667-1, TCVN 5992-1995 (ISO 5667-2) và TCVN 5993-1995 (ISO 5667-3).
8 Cách tiến hành
8.1 Chuẩn bị mẫu thử, lọc và cấy vào môi trường
Để chuẩn bị mẫu, pha loãng, lọc và môi trường cấy phân lập theo hướng dẫn nêu trong ISO 8199 và ISO 6887.
8.1.1 Đối với vi khuẩn coliform , tiến hành lọc một lượng mẫu hoặc dịch pha loãng của nó qua một màng lọc. Đặt vào môi trường đã chọn nhưng phải đảm bảo không tạo thành bọt không khí ở dưới màng.
8.1.2 Đối với vi khuẩn coliform chịu nhiệt, tiến hành lọc một lượng mẫu hoặc dịch pha loãng của nó qua một màng lọc. Đặt vào môi trường đã chọn nhưng phải đảm bảo không tạo thành bọt không khí ở dưới màng.
Chú thích 2 - Thể tích mẫu lọc được phải giống như thể tích mẫu trong 8.1.1.
8.2 Nuôi màng lọc
8.2.1 Đối với vi khuẩn coliform, nuôi màng lọc từ 18 giờ đến 24 giờ ở 350C ± 0,50C hoặc ở 370C ± 0,50C .
8.2.2 Đối với vi khuẩn coliform chịu nhiệt, nuôi màng lọc từ 18 giờ đến 24 giờ ở 440C ± 0,250C hoặc 44,50C ± 0,250C .
Chú thích
3) Nói chung cùng một môi trường có thể dùng đẻ khử cả vi khuẩn coliform lẫn vi khuẩn coliform chịu nhiệt nhưng chỉ dùng môi trường m FC ở 440C và chỉ dùng môi trường Endo và LES Endo ở 350C hoặc 370C;
4) Giai đoạn nuôi 4 giờ đầu nên giữ nhiệt độ thấp 300C để làm những vi khuẩn cố sống lại, đặc biệt đối với việc xét nghiệm nước uống.
8.3 Kiểm tra màng lọc
8.3.1 Vi khuẩn coliform
Kiểm tra màng lọc và đếm tất cả các khuẩn lạc vi khuẩn coliform giả định, không kể kích thước thấy được sau khi ủ ở 350C hoặc 370C với các đặc tính sau đây:
- Trên môi trường thạch TTC lactoza với Tegitol (5.3.1): màu vàng, da cam hoặc hoặc đỏ gạch với vòng sáng trung tâm màu vàng trong môi trường dưới màng;
-Trên môi trường thạch lactoza với Tegitol (5.3.2): với vòng sáng trung tâm màu vàng trong môi trường dưới màng;
- Trên màng canh thang Teepol được làm giàu (5.3.3): màu vàng lan rộng trên màng lọc;
- Trên màng canh thang sufat Lauryl (5.3.4): màu vàng lan rộng trên màng lọc;
- Trên thạch Endo hoặc canh thang (5.3.5): màu đỏ sẫm với ánh kim loại xanh vàng;
- Trên thạch LES Endo (5.3.6): màu đỏ sẫm với ánh kim loại xanh vàng;
8.3.2 Vi khuẩn coliform chịu nhiệt
Tất cả các bào tử sau khi nuôi ở 440C có biểu hiện cùng một đặc tính bào tử có màu xanh như mô tả ở 8.3.1 với môi trường mFC (5.3.7) thì được coi là vi khuẩn coliform giả định chịu nhiệt.
8.4 Thử khẳng định
Điều quan trọng cần lưu ý là việc đếm các bào tử trên màng lọc ở 350C hoặc 370C và 440C chỉ là kết quả coliform giả định. Khi việc sinh khí không phát hiện được, có thể là có một giả định khác là các vi khuẩn tạo thành khuẩn lạc có thể tạo ra khí từ lactoza. Thí dụ đối với nước thô hoặc nước đã được xử lý sơ bộ thì điều này cũng có thể là đủ nhưng đối với nước uống và các trường hợp khác, điều quan trọng là tiến hành thử khẳng định, tốt hơn hết là trên các chủng cấy thuần khiết.
8.4.1 Cấy truyền, nuôi và kiểm tra
8.4.1.1. Vi khuẩn coliform
Để khẳng định kết quả, cấy truyền mỗi khuẩn lạc (8.3.1) hoặc một số đại diện của chúng vào ống nước pepton lactoza (5.4.1) và nuôi ở 350C hoặc 370C trong 48 giờ, việc sinh khí trong thời gian này chứng tỏ có vi khuẩn coliform.
8.4.1.2 Vi khuẩn coliform chịu nhiệt và E. Coli giả định
Để xác định vi khuẩn coliform chịu nhiệt và E. Coli giả định trên màng được nuôi ở 440C hoặc 350C hoặc 370C, cấy truyền mỗi khuẩn lạc (8.3.2) hoặc một số đại diện của chúng vào ống nước pepton lactoza và nuôi ở 440C trong 24 giờ. Việc sinh khí trong nước pepton lactoza khẳng định sự có mặt của vi khuẩn coliform chịu nhiệt và việc tạo nên màu đỏ trên bề mặt môi trường nuôi cấy nước trypton sau khi thêm 0,2 ml đến 0,3 ml thuốc thử Kovac (5.5.1) khẳng định sự có mặt của E. Coli giả định.
Chú thích
5) Việc sử dụng canh thang manitol trypto lauryl có tryptophan cho phép phát triển cả sinh khí và indol trong ống đơn;
6) Việc phát hiện E. Coli giả định được xem như chứng cứ chắc chắn về sự ô nhiễm phân;
7) Khi cấy truyền các khuẩn lạc trên màng vào ống môi trường khẳng định, tốt nhất cũng nên cấy lên đó một đĩa môi trường thạch dinh dưỡng để thử oxidaza.
8.5 Thử oxidaza
Một vài chủng vi khuẩn tìm thấy trong nước có thể phù hợp với định nghĩa vi khuẩn coliform ở hầu hết khía cạnh, nhưng chúng chỉ có thể sinh khí từ lactoza ở nhiệt độ dưới 370C. Do đó chúng cho các kết quả thử âm tính trong các phép thử khẳng định chuẩn đối với các vi khuẩn coliform và sự hiện diện của chúng trong nước thường không đáng kể. Các chủng aeromonas xuất hiện một cách tự nhiên trong nước sinh trưởng tốt nhất ở nhiệt độ từ 300C đến 350C nhưng không bao giờ sinh axit và khí từ lactoza ở 370C. Có thể nhận biết chúng trong nhóm vi khuẩn coliform bằng phản ứng oxidaza dương tính.
8.5.1 Tiến hành thử oxidaza bằng cách cấy truyền thuần khiết từ các vi khuẩn lên men lactoza, phát triển trên môi trường thạch dinh dưỡng như sau:
cho 2 đến 3 giọt thuốc thử oxidaza vừa mới chuẩn bị lên giấy lọc trong đĩa Petri bằng que cấy thuỷ tinh, tẩm bông hoặc que cấy có dây bạch kim (không phải loại nicrom), dàn mỏng một ít mẫu cấy lên giấy lọc (xem chú thích 7) sự xuất hiện màu xanh thẫm trong vòng 10 giây là thể hiện phản ứng dương tính.
Chú thích 8 _ Trong mỗi trường hợp sử dụng thuốc thử oxidaza cần tiến hành kiểm tra thử bằng cách cấy các vi khuẩn đã biết phản ứng dương tính (pseudomonas aeruginosa) và phản ứng âm tính (E. Coli).
9 Biểu thị kết quả
Từ số các khuẩn lạc đặc trưng đếm được trên màng lọc có tính đến kết quả của phép thử khẳng định đã nhận được, tính số vi khuẩn coliform, vi khuẩn coliform chịu nhiệt và E. Coli giả định có trong 100 ml mẫu theo ISO 8199, điều 8.4 theo công thức:
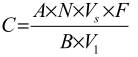
trong đó
C là số bào tử được khẳng định, tính trong 100 ml;
A là số bào tử thực được khẳng định;
B là số bào tử được cấy truyền để thử khẳng định;
N là số các bào tử đặc trưng trên màng (8.3.1 và 8.3.2);
V1 là thể tích thử của mẫu nước được lọc (8.1 và 8.1.2);
Vs là thể tích chuẩn để tính kết quả (100 ml);
F là hệ số pha loãng.
10 Báo cáo kết quả
Báo cáo kết quả cần bao gồm các thông tin sau:
a) tham khảo tiêu chuẩn này;
b) tất cả các chi tiết cần thiết để nhận biết đầy đủ về mẫu;
c) kỹ thuật và môi trường phân lập đã sử dụng;
d) môi trường và phép thử xác nhận đã sử dụng;
e) thời gian, nhiệt độ và điều kiện nuôi cấy;
f) kết quả biểu thị theo điều 9;
g) các thông tin khác liên quan đến phương pháp.
PHỤ LỤC A
(Tham khảo)
THÔNG TIN SÂU HƠN VỀ VI SINH HỌC LIÊN QUAN TỚI KIỂM TRA NƯỚC ĐỐI VỚI NHÓM VI KHUẨN COLIFORM
Đối với các mục đích kiểm tra nước hàng ngày, nhóm vi khuẩn coliform có thể được mô tả bằng các thuật ngữ vi sinh chung, không mang tính phân loại học, như sau:
Các vi khuẩn coliform là các vi khuẩn hình que (dạng thẳng), gram âm, không có bào tử, oxidaza -âm tính; chúng có khả năng sinh trưởng hiếu khí và kị khí không bắt buộc trong sự có mặt của muối mật (hoặc các yếu tố tác động bề mặt khác có đặc tính ức chế sinh trưởng tương tự). Chúng cũng có thể lên men lactoza (và mannit) kèm theo tạo thành axit, khí, và andehyt trong vòng 48 giờ, khi nuôi cấy ở nhiệt độ từ 350C tới 370C.
Các vi khuẩn coliform chịu nhiệt là các vi khuẩn coliform cho thấy có cùng khả năng lên men và các đặc tính sinh hoá khi nuôi cấy ở nhiệt độ từ 440C đến 44,50C. E. coli giả định là các vi khuẩn coliform chịu nhiệt, chúng cũng có khả năng sinh indol từ tryptophan.
E. Coli có thể được xem là E. coli giả định, chúng cũng cho một kết quả dương tính trong phép thử metyl đỏ và có thể loại cacboxyl của axit glutamic, nhưng chúng không có khả năng tạo ra metyl axetyl cacbinol, sử dụng xitrat như nguồn cácbon duy nhất, hoặc sinh trưởng trong canh thang kali xyanua (KCN).
PHỤ LỤC B
(tham khảo)
MÔI TRƯỜNG NUÔI CẤY, THUỐC THỬ VÀ DỊCH PHA LOÃNG
Môi trường phân lập
Thạch lactoza TTC có Tegitol 7
Môi trường cơ bản
|
Lactoza Pepton Cao men Canh thịt Bromothymol xanh Thạch Nước cất |
20 g 10 g 6 g 5 g 0,05 g từ 16 đến 25 g 1) 1.000 ml |
|
1) Phụ thuộc vào độ bền gel của thạch |
|
Hoà tan các thành phần trong nước sôi. Nếu cần thiết điều chỉnh pH sao cho sau khi khử trùng có pH 7,2 ± 0,2. Cho môi trường vào chai 100 ml và khử trùng trong nồi hấp áp lực ở 1210C ± 10C trong 15 phút.
Dung dịch TTC
2, 3, 5 - Tryphenol-tetrazo clorua (TTC) 0,05 g
Nước cất 100 ml
Hoà tan TTC trong một ít nước và thêm nước đến 100 ml. Khử trùng bằng cách lọc qua một màng lọc có kích thước lỗ < 0,2="" μm.="">
Dung dịch Tegitol 7
Tegitol 7 0,2 g
Nước cất 100 ml
Hoà tan Tegitol 7 trong một ít nước và thêm nước đến 100 ml. Khử trùng trong nồi hấp áp lực ở 1210C ± 10C trong 15 phút.
Môi trường hoàn chỉnh
Môi trường nền 100 ml
Dung dịch TTC 5 ml
Dung dịch Tegitol 7 5 ml
Làm tan môi trường nền và làm nguội xuống 450C đến 500C. Thêm dung dịch TTC và Tegitol 7. Khuấy kỹ nhưng tránh để tạo bọt sau mỗi lần thêm. Cho vào đĩa petri một lớp môi trường dày khoảng 5 mm. Nếu không dùng ngay, bảo quản ở 40C trong chỗ tối nhưng không quá 10 ngày.
Thạch lactoza có Tegitol 7
|
Pepton Cao men Lactoza Tegitol 7 Bromothymol xanh Thạch Nước cất |
5 g 3 g 10 g 0,1 ml 0,025 g 15 g 1.000 ml |
Hoà tan các thành phần trong nước. Cho vào chai 100 ml và hấp áp lực ở 1210C ± 10C trong 15 phút.
pH cuối cùng phải là 6,9 ± 0,2. Để sử dụng, làm tan và cho vào các đĩa petri một lớp dày khoảng 5
mm. Bảo quản ở 40C trong chỗ tối nhưng không quá 10 ngày.
Canh thang Teepol làm giàu màng
|
Pepton Cao men Lactoza Phenol đỏ (0,4% khối lượng/khối lượng) dung dịch nước Teepol 610 Nước cất |
40 g 6 g 30 g 50 ml
4 ml 1.000 ml |
Thêm pepton và cao men vào nước và dùng hơi nóng để hoà tan. Thêm lactoza, phenol đỏ và sau cùng là Teepol, khuấy nhẹ để tránh tạo bọt. pH sau khi khử trùng phải từ 7,4 đến 7,5, để đạt được pH này có thể điều chỉnh pH trước khi khử trùng là 7,6. Cho vào chai có nút xoáy và hấp trong nồi hấp áp lực ở 1100C đến 1150C trong 10 phút.
Màng canh thang sunfat lauryl
|
Pepton Cao men Lactoza Phenol đỏ (0,4% khối lượng/khối lượng) trong nước Natri lauryl sunfat rất tinh khiết Nước cất |
40 g 6 g 30 g 50 ml 1 g 1000 ml |
Cho các thành phần vào nước và khuấy nhẹ để tránh tạo bọt. pH cuối phải là 7,4 đến 7,5, nếu cần có thể điều chỉnh pH đến khoảng 7,6 trước khi khử trùng để đạt được độ pH nói trên, phân phối vào chai có nút xoáy và hấp áp lực ở 1100C đến 1150C trong 10 phút.
Môi trường Endo
Cảnh báo - Fuchsin kiềm có thể gây ung thư
|
Tryptoza Thio pepton Trypticase (casiton hoặc trypton) Cao men Lactoza Natri clorua Dikali hydro photphat Kali dihydro photphat Natri lauryl sunfat Natri desoxycolat Natri sunfat Fuchsin nền Nước cất |
10 g 5 g 5 g 1,5 g 12,5 g 5 g 4,375 g 1,375 g 0,05 g 0,1 g 2,1 g 1,05 g 1000 ml |
Hoà tan các thành phần trong nước có chứa 20 ml cồn (etanola) 95% (thể tích). Không hấp áp lực nhưng phải đun đến sôi. Lấy ra và làm nguội đến 450C - 500C. pH cuối cùng phải là 7,2 ± 0,2. Bảo quản môi trường này ở 40C ở chỗ tối và vứt bỏ môi trường không sử dụng sau 4 ngày.
Chú thích 9 - Có thể làm đặc môi trường này bằng cách thêm 12 g/l - 15 g/l thạch trước khi đun sôi.
Thạch LES Endo
Cảnh báo - Fuchsin nền có thể gây ung thư
|
Cao men Trypicase (casiton hoặc tryptone) Thiopepton Tryptoza Lactoza Dikali hydro photphat Natri dihydro photphat Natri clorua Natri lauryl sunfat Natri sunphit Fuchsin nền Thạch Nước cất |
1,2 g 3,7 g 3,7 g 7,5 g 9,4 g 3,3 g 1,0 g 3,7 g 0,1 g 0,05 g 1,6 g 0,8 g 15 g 1.000 ml |
Hoà tan các thành phần trong nước có chứa 20 ml etanol 95% (nồng độ thể tích). Không hấp bằng nồi hấp áp lực nhưng phải đun đến sôi, làm nguội đến 450C đến 500C và cho 4 ml vào đĩa petri nhỏ (đường kính 60 mm). pH cuối cùng phải là 7,2 ± 0,2. Bảo quản đĩa ở 40C trong chỗ tối và loại bỏ môi trường không dùng sau hai tuần. Tránh ánh sáng mặt trời chiếu trực tiếp.
Môi trường mFC
|
Tryptoza Proteose pepton No.3 hoặc poly-pepton Cao men Natri clorua Lactoza Muối mật No.3 hoặc hỗn hợp muối mật Anilin xanh Nước cất |
10,0 g 5,0 g 3,0 g 5,0 g 12,5 g 1,5 g 0,1 g 1000 ml |
Hydrat hoá lại trong nước cất đã chứa 10 ml axit rosolic 1% trong NaOH nồng độ 0,2 mol/l. Đun nóng môi trường đến điểm sôi. Lấy ra làm nguội xuống 450C đến 500C. Không khử trùng bằng nồi hấp áp lực. pH cuối cùng phải là 7,4 ± 0,2. Bảo quản môi trường cuối cùng này ở nhiệt độ từ 20C đến 100C và đổ bất kỳ môi trường nào không sử dụng sau 96 giờ.
Chú thích
10) Có thể làm đặc môi trường này bằng cách thêm 1,2% đến 1,5% thạch trước khi đun sôi;
11) Axit rosolic sẽ phân huỷ nếu khử trùng trong nồi áp lực. Dung dịch gốc cần phải bảo quản trong chỗ tối từ 20C đến 100C và loại bỏ sau hai tuân, hoặc loại bỏ sớm hơn nếu màu của dung dịch chuyển từ màu đỏ sẫm đến nâu đục.
Môi trường khẳng định
Nước pepton lactoza (để kiểm tra sự sinh khí)
|
Pepton Natri clorua Lactoza Phenol đỏ (0,4% khối lượng/khối lượng) dung dịch nước (hoặc chỉ thị Andrad) Nước cất |
10 g 5 g 10 g 2,5 ml (10 ml) 1000 ml |
Hoà tan các thành phần trong nước và điều chỉnh pH đến 7,5 ± 0,2. Thêm chỉ thị phenol đỏ và lấy 5 ml vào ống nghiệm chứa ống lên men lộn ngược (Durham). Có thể làm cách khác bằng cách điều chỉnh pH từ 6,8 đến 7,0 và thêm chỉ thị Andrad. Hấp trong nồi áp lực ở 1100C trong 10 phút. Có thể hấp bằng hơi trong 3 ngày liên tục, mỗi ngày 20 phút. Kiểm tra mức độ khử trùng bằng cách ủ ở nhiệt độ 370C trong 24 giờ. Điều quan trọng là phải đảm bảo sau khi hấp áp lực và trước khi sử dụng, ống Durham phải được chứa đầy hoàn toàn môi trường. Nếu không có thể nhận được việc sinh khí do kết quả phản ứng dương tính giả.
Chất chỉ thị Andrad
Chất chỉ thị này được chuẩn bị bằng cách hoà tan 0,5 g axit fuchsin trong 100 ml nước cất. Thêm 17 ml dung dịch natri hydroxit (1 mol/l) và để ở nhiệt độ phòng qua đêm. Sáng ngày hôm sau dung dịch phải chuyển thành màu vàng nhạt. Nếu dung dịch có màu hơi nâu, thêm một ít dung dịch natri hydroxit và lại để yên. Dung dịch này có tính kiềm mạnh và phải điều chỉnh pH của môi trường thường xuyên để có pH khoảng 6,8.
Nước trypton (để thử phản ứng sinh indol)
Lượng pepton nhất định cho kết quả thích hợp trong phép thử ở 350C hoặc 370C lại không đủ cho phép thử indol ở 440C. Lượng tryptol thích hợp nên dùng như sau
|
Trypton Natri clorua Nước cất |
20 g 5 g 1000 ml |
Hoà tan các thành phần trong nước và điều chỉnh pH đến 7,5. Lấy 5 ml và hấp ở nồi hấp áp lực ở 1150C trong 10 phút.
Chú thích 12 - Việc thêm 0,1% (thể tích) D hoặc DL tryptophan có thể cải thiện được đặc tính của môi trường
Canh thang manitol Lauryl trytoza có tryptophan
(Môi trường ống đơn để kiểm tra cả sinh khí và indol)
|
Tryptoza Manitol Natri clorua Dikali hydro photphat Kali dihydro photphat Natri Lauryl sunfat L (-) tryptophan Nước cất |
20 g 5 g 5 g 2,75 g 2,75 g 0,1 g 0,2 g 1000 ml |
Thêm trypto, natri clorua, manitol, photphat và tryptophan vào nước và đun nóng để hoà tan. Thêm natri lauryl sunfat và khuấy nhẹ để tránh tạo bọt. Điều chỉnh pH đến 6,8 ± 0,2. Lấy 5 ml vào ống chứa ống lên mên lật ngược ở phía trong (durham). Hấp áp lực ở 1150C trong 10 phút.
Thuốc thử
Thuốc thử Kovac để thử indol
|
p - dimetylaminbezandehyt Amyl alcol (không chứa các gốc hữu cơ) Axit clohydric (p = 1,18 g/ml) |
5 g 75 ml 25 ml |
Hoà tan andehyt trong amyl alcol. Cẩn thận thêm axit đậm đặc vào. Bảo quản ở 40C tránh ánh sáng.
Chú thích 13 - Thuốc thử phải có màu vàng nhạt đến màu nâu; một số mẫu amyl alcol không phù hợp và cho màu tối với andehyt.
Thuốc thử oxidaza
Tetrametyl - p - phenylenediamin hydro clorua 0,1 g
Nước cất 10 ml
Thuốc thử này không bền nên chỉ chuẩn bị một lượng nhỏ trước khi sử dụng theo yêu cầu.
Dịch pha loãng
Dịch pha loãng pepton (0,1%)
Pepton 1,0 g
Nước cất 1000 ml
Hoà tan pepton trong khoảng 950 ml nước. Điều chỉnh pH của dung dịch bằng dung dịch natri hydroxit hoặc axit clohydric (1 mol/l) sao cho sau khi khử trùng pH phải 7,0 ± 0,1. Thêm nước đến 1000 ml, phân chia theo các thể tích thích hợp và hấp áp lực ở 1210C ± 10C trong 15 phút.
Dung dịch Ringer - nồng độ một phần tư
|
Natri clorua Kali clorua Canxi clorua khan Natri bicacbonat Nước cất |
2,25 g 0,105 g 0,12 g 0,05 g 1000 ml |
Hoà tan các thành phần và phân chia theo các thể tích thích hợp. Khử trùng bằng cách hấp ở 1210C ± 10C trong 15 phút. pH sau khi khử trùng phải là 7,0 ± 0,1.
Dung dịch đệm photphat
|
Kali dihydro photphat Magie clorua Nước cất |
42,5 mg 190 mg 1000 ml |
Chuẩn bị
a) dung dịch photphat
Hoà tan 34 g photphat trong 500 ml nước cất. Điều chỉnh pH đến 7,2 ± 0,5 bằng dung dịch natri hydroxit (1 mol/l) và thêm nước cất đến 1000 ml;
b) dung dịch magie clorua
Hoà tan 38 g magie clorua trong 1000 ml nước cất. Dung dịch cuối cùng
Để sử dụng, thêm 1,25 ml dung dịch photphat và 5,0 ml dung dịch magie clorua vào 1000 ml nước cất. Phân chia theo các thể tích thích hợp và khử trùng bằng cách hấp áp lực ở 1210C ± 10C trong 15 phút. pH sau khi khử trùng phải là 7,0 ± 0,1.
Thạch dinh dưỡng
|
Cao thịt Pepton Natri clorua Thạch |
1,0 g 1,0 g 5 g 15 g |
Cho các thành phần vào nước đã đun nóng để hoà tan. Điều chỉnh pH về khoảng 8,2 bằng natri hydroxit (1 mol/l) và đun sôi trong 10 phút. Lọc trong và điều chỉnh pH từ 7,2 đến 7,4. Cho vào chai dung tích 100 ml và hấp áp lực ở 1210C ± 10C trong 15 phút.

