Nội dung toàn văn Tiêu chuẩn quốc gia TCVN 9332:2012 (ISO/TS 19036 : 2006) về Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Hướng dẫn ước lượng độ không đảm bảo đo đối với các phép phân tích định lượng
TIÊU CHUẨN QUỐC GIA
TCVN 9332 : 2012
ISO/TS 19036 : 2006
WITH AMENDMENT 1 : 2009
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - HƯỚNG DẪN ƯỚC LƯỢNG ĐỘ KHÔNG ĐẢM BẢO ĐO ĐỐI VỚI CÁC PHÉP PHÂN TÍCH ĐỊNH LƯỢNG
Microbiology of food and animal feeding stuffs - Guidelines for the estimation of measurement uncertainty for quantitative determination
Lời nói đầu
TCVN 9332:2012 hoàn toàn tương đương với ISO/TS 19036:2006 và Bổ sung 1:2009;
TCVN 9332:2012 do Viện Kiểm nghiệm an toàn vệ sinh thực phẩm quốc gia biên soạn. Bộ Y tế đề nghị, Tổng cục Tiêu chuẩn Đo lường Chất lượng thẩm định, Bộ Khoa học và Công nghệ công bố.
Lời giới thiệu
Hướng dẫn biểu thị độ không đảm bảo đo (GUM)[15] là phương pháp chuẩn được chấp nhận rộng rãi, được khuyến cáo dùng để ước lượng các phân bố phương sai của từng nguồn riêng biệt gây ra độ không đảm bảo đo trong quá trình đo lường, như được minh họa trong các ví dụ. Sau đó, độ không đảm bảo đo tổng hợp thu được bằng cách sử dụng các nguyên tắc về sự lan truyền về độ không đảm bảo đo. Phương pháp tiếp cận này đã được mô tả theo cách thực tiễn hơn về đo lường phân tích, chủ yếu liên quan đến phân tích bản chất hóa học đề cập trong hướng dẫn EURACHEM/CITAC [16] và vi sinh vật đề cập trong Tài liệu tham khảo [17].
Tiểu ban kỹ thuật ISO/TC 34/SC 9 cho rằng phương pháp “từng bước” (“step-by-step”) như trên không được áp dụng thỏa đáng khi phân tích vi sinh vật trong thực phẩm vì khó xây dựng mô hình thực sự toàn diện về quá trình đo. Do có thể không nhận biết được một nguồn thay đổi đáng kể nên có nguy cơ đánh giá không đúng mức giá trị độ không đảm bảo đo (MU) Ngoài ra, sẽ khó định lượng chính xác sự góp phần của từng bước riêng biệt trong quá trình phân tích vi sinh vật thực phẩm do:
- đối tượng phân tích là sinh vật sống mà trạng thái sinh lí của nó có thể thay đổi với mức độ lớn;
- mục đích của phép phân tích bao gồm các chủng, các loài hoặc các giống khác nhau.
Nói cách khác, phân tích vi sinh vật không thể là hệ thống đo lường chính xác và ước lượng đúng giá trị thống kê về MU.
Vì vậy, Tiểu ban kỹ thuật ISO/TC 34/SC 9 đã chọn phương pháp “trên-dưới” (“top-down”) hay “tổng thể” (“global”) đối với MU, dựa trên độ lệch chuẩn tái lập của kết quả cuối cùng của quá trình đo. Đây là phương pháp dựa vào các kết quả thực nghiệm (sự lặp lại của cùng một phép phân tích) mà trong lĩnh vực vi sinh vật, nó dường như có ý nghĩa hơn phương pháp từng bước.
Phương pháp tổng thể đã được Ban kỹ thuật ISO/TC 69 Áp dụng các phương pháp thống kê, SC 6 Phương pháp và kết quả đo lường đưa vào sử dụng trong ISO/TS 21748. Tiêu chuẩn này làm sáng tỏ phương pháp từng bước và phương pháp tổng thể không loại trừ nhau, vì tất cả các thành phần của MU có thể được tính đến trong việc thực hiện tổng thể quá trình phân tích, đặc trưng bởi độ chụm và độ chệch quan sát được.
VI SINH VẬT TRONG THỰC PHẨM VÀ THỨC ĂN CHĂN NUÔI - HƯỚNG DẪN ƯỚC LƯỢNG ĐỘ KHÔNG ĐẢM BẢO ĐO ĐỐI VỚI CÁC PHÉP PHÂN TÍCH ĐỊNH LƯỢNG
Microbiology of food and animal feeding stuffs - Guidelines for the estimation of measurement uncertainty for quantitative determination
1. Phạm vi áp dụng
Tiêu chuẩn này đưa ra hướng dẫn để ước lượng và biểu thị độ không đảm bảo đo (MU) liên quan đến các kết quả định lượng vi sinh vật trong thực phẩm.
Tiêu chuẩn này áp dụng cho các phân tích định lượng sử dụng kỹ thuật đếm khuẩn lạc hoặc phương pháp sử dụng thiết bị khác trong:
- thực phẩm và thức ăn chăn nuôi;
- các mẫu môi trường trong khu vực sản xuất và chế biến thực phẩm.
Tiêu chuẩn này không áp dụng cho việc định lượng sử dụng kỹ thuật tính số có xác suất lớn nhất.
Trong tiêu chuẩn này, MU được ước lượng bằng cách sử dụng phương pháp giản lược đưa vào trong tính phân bố Poisson và sau đó có thể áp dụng cho bất kỳ kết quả nào, bao gồm các số đếm “thấp” và/hoặc số lượng “thấp” vi sinh vật1).
Phương pháp nêu trong tiêu chuẩn này là phương pháp tổng thể dựa vào độ lệch chuẩn của độ tái lập của kết quả đo cuối cùng.
2. Thuật ngữ và định nghĩa
Trong tiêu chuẩn này sử dụng các thuật ngữ và định nghĩa sau:
2.1. Độ không đảm bảo (của phép đo) [uncertainty (of measurement)]
Thông số gắn liền với kết quả của phép đo, đặc trưng cho sự phân tán các giá trị có thể quy cho đại lượng đo một cách hợp lí.
CHÚ THÍCH 1: Ví dụ, thông số có thể là độ lệch chuẩn (hoặc bội số của độ lệch chuẩn) hoặc một nửa khoáng với mức tin cậy đã được công bố.
CHÚ THÍCH 2: Nhìn chung, độ không đảm bảo đo bao gồm nhiều thành phần. Một số trong các thành phần này có thể được đánh giá từ phân bố thống kê của các kết quả của một dãy phép đo và có thể được đặc trưng bởi các độ lệch chuẩn thực nghiệm. Các thành phần khác, cũng có thể được đặc trưng bởi các độ lệch chuẩn được đánh giá từ các phân bố xác suất được thừa nhận dựa trên thực nghiệm hoặc thông tin khác.
CHÚ THÍCH 3: Kết quả của phép đo được hiểu là sự ước lượng tốt nhất giá trị của đại lượng đo và toàn bộ các thành phần của độ không đảm bảo, bao gồm các tác động mang tính hệ thống phát sinh như các thành phần liên quan đến việc hiệu chính và chuẩn chính, góp phần vào sự phân tán.
[GUM:1993(15)]
2.2. Độ không đảm bảo chuẩn (standard uncertainty)
u(Xi)
Độ không đảm bảo của kết quả phép đo được thể hiện như đô lệch chuẩn.
[GUM:1993(15)]
2.3. Độ không đảm bảo chuẩn tổng hợp (combined standard uncertainty)
uc(y)
Độ không đảm bảo chuẩn của kết quả phép đo khi kết quả đó nhận được từ các giá trị của một số đại lượng khác, tương đương với căn bậc hai dương của tổng các số hạng. Các số hạng khác nhau hoặc phương sai của các đại lượng khác này tác động tùy thuộc vào các giá trị kết quả phép đo như thế nào khi thay đổi chúng.
[GUM:1993 (15)]
2.4. Độ không đảm bảo đo mở rộng (expanded uncertainly)
U
Đại lượng xác định một khoảng bao quanh kết quả của phép đo mong muốn sẽ chứa phần lớn phân bố của các giá trị có thể quy một cách hợp lí cho đại lượng đo.
CHÚ THÍCH 1: Phần này có thể được coi như xác xuất bao phủ hoặc độ tin cậy của khoảng.
CHÚ THÍCH 2: Để kết hợp độ tin cậy đặc trưng với khoảng được xác định bởi độ không đảm bảo mở rộng đòi hỏi các giả định hiện hoặc ẩn liên quan đến phân bổ xác suất đặc trưng bởi kết quả phép đo và độ không đảm bảo chuẩn kết hợp của nó. Độ tin cậy có thể quy cho khoảng này chỉ phân biệt trong phạm vi có thể chứng minh được những giả định như vậy.
[GUM:1993 (15)]
CHÚ THÍCH 3: Độ không đảm bảo đo mở rộng U được tính từ độ không đảm bảo đo chuẩn tổng hợp uc(y) và hệ số phủ k theo công thức
U = kuc(y)
2.5. Hệ số phủ (coverage factor)
k
Hệ số được sử dụng làm số nhân với độ không đảm bảo chuẩn tổng hợp để có được độ không đảm bảo đo mở rộng.
CHÚ THÍCH: Hệ số phủ k thường trong phạm vi từ 2 đến 3.
[GUM:1993(15)].
2.6. Độ chệch (bias)
Mức độ sai khác giữa giá trị kì vọng của các kết quả thử nghiệm và giá trị quy chiếu được chấp nhận.
CHÚ THÍCH: Độ chệch là sai số hệ thống tổng hợp khác với sai số ngẫu nhiên. Có thể có một hay nhiều thành phần sai số hệ thống đóng góp vào độ chệch. Sự sai khác hệ thống so với giá trị quy chiếu được chấp nhận càng lớn thì độ chệch càng lớn.
[TCVN 8244-1:2010 (ISO 3534-1:2006)].
3. Nguyên tắc
3.1. Phương pháp tổng thể ước lượng độ không đảm bảo đo (MU)
Tiêu chuẩn này đưa ra phương pháp tổng thể được chấp nhận để ước lượng độ không đảm bảo đo. Độ không đảm bảo đo dựa trên độ biến thiên chung của cả quá trình dẫn đến kết quả phân tích. Độ biến thiên chung này bao gồm cả độ chụm thấy được (thành phần ngẫu nhiên) và độ chệch (thành phần hệ thống). Trong thực tế của lĩnh vực vi sinh vật trong thực phẩm, chỉ có độ chụm được đưa vào tính toán (xem 3.2).
Phương pháp tổng thể để ước lượng MU trong tiêu chuẩn này thu được từ ước lượng thực nghiệm độ lệch chuẩn tái lập kết quả cuối cùng của quá trình đo hoàn chỉnh. Độ lệch chuẩn này tương ứng với độ không đảm bảo chuẩn tổng hợp (xem 4.1).
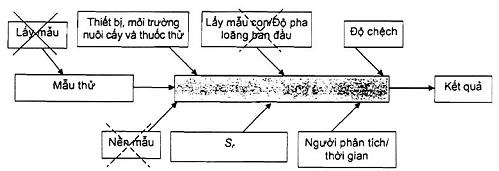
Phương pháp tổng thể có thể được coi như một hệ thống “hộp đen” (như được minh họa trong Hình 1) để xác định các nguồn chính của độ không đảm bảo khi phân tích vi sinh trong thực phẩm. Sơ đồ như vậy có thể giúp ích trong việc xác định các nguồn của độ không đảm bảo, được bao gồm hoặc không bởi quy trình thử nghiệm đã chọn.
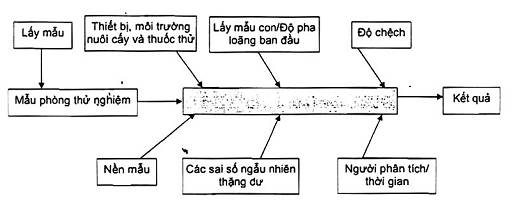
Hình 1 - Sơ đồ về các nguồn chính của độ không đảm bảo đo khi phân tích vi sinh vật trong thực phẩm, và phương pháp “hộp đen’’ về độ không đảm bảo đo
Trong Hình 1, việc lấy mẫu (lấy ra các đơn vị mẫu thử nghiệm từ lô được kiểm soát) nói lên một phần ý nghĩa (nếu không phải là chủ yếu) của sai số tổng nhưng không phải là phần không đảm bảo gắn liền với chính phép đo. Mẫu con có nghĩa là phần mẫu thử lấy ra từ mẫu phân tích (một trong những đơn vị lấy ra từ lô). Phần mẫu thử này được dùng để chuẩn bị dung dịch huyền phù ban đầu các kỹ thuật định lượng vi khuẩn theo TCVN 6507-1 (ISO 6887-1). Các nguồn chính của độ không đảm bảo trong quá trình phân tích là người phân tích/thời gian và thiết bị/môi trường nuôi cấy/thuốc thử. Cuối cùng, các sai số ngẫu nhiên hệ thống thặng dư là cái không được giải thích bởi các yếu tố trước và thường được đánh giá trong phòng thử nghiệm trong các điều kiện lặp lại.
Trong khi đó, sự chấp nhận phương pháp tổng thể này đòi hỏi các kết quả của quá trình đo phải chứng minh là đã được kiểm soát.
3.2. Xem xét độ chệch
Điều thường được cân nhắc là không đưa độ chệch vào trong tính độ không đảm bảo đo theo kinh nghiệm về bản chất định lượng vi sinh vật. Nói cách khác, quy trình phân tích xác định trực tiếp kết quả của phép đo, ví dụ số khuẩn lạc trên đơn vị mẫu. Vì vậy, trong thực tế không thể xác định giá trị thực cần thiết cho quyết định độ chệch. Thậm chí khi sử dụng các mẫu chuẩn được chứng nhận, hoặc các giá trị nhận được từ các thử nghiệm liên phòng cũng chỉ đánh giá được một phần độ chệch tổng.
Trong khi đó, điều đã được thừa nhận là phần độ chệch có thể đánh giá qua các nghiên cứu liên phòng đã được sử dụng trong hai lựa chọn còn lại của tiêu chuẩn này để đánh giá độ lệch chuẩn tái lập (xem Điều 6 và Điều 7). Phương pháp tính đến thành phần độ chệch của độ không đảm bảo không được mô tả trong tiêu chuẩn này. Tuy vậy, ngay cả khi thành phần độ chệch của MU không được đánh giá chính thức thì cũng có thể chỉ ra độ chệch của phòng thử nghiệm bằng cách kiểm soát đơn vị tham gia, ví dụ: trong thử nghiệm thành thạo liên phòng hoặc bằng cách thử nghiệm các mẫu chuẩn (đã được chứng nhận).
4. Các khía cạnh chung
4.1. Độ không đảm bảo chuẩn tổng hợp
Khi các thành phần chính của độ không đảm bảo đo được kiểm soát (xem 3.1), thông thường thì độ không đảm bảo chuẩn tổng hợp uc(y) (2.3) là sự kết hợp độ không đảm bảo chuẩn liên quan đến độ chụm và tới độ chệch, nếu thích hợp.
Độ không đảm bảo chuẩn tổng hợp ước lượng trong tiêu chuẩn này bằng độ lệch chuẩn tái lập thực nghiệm kết quả cuối cùng của phép đo, tổng hợp với một thành phần bằng phân bố Poisson.
CHÚ THÍCH: Phương pháp kết hợp độ không đảm bảo chuẩn liên quan đến độ chệch không được mô tả ở đây.
4.2. Độ lệch chuẩn tái lập
Ba khả năng khác nhau đã được lựa chọn để ước tính độ lệch chuẩn tái lập (sR) theo thứ tự ưu tiên sau:
- Sự lựa chọn thứ nhất: Độ lệch chuẩn tái lập trong phòng thử nghiệm;
- Sự lưa chọn thứ hai: Độ lệch chuẩn tái lập của phương pháp nhận được từ nghiên cứu liên phòng;
- Sự lựa chọn thứ ba: Độ lệch chuẩn tái lập nhận được từ thử nghiệm thành thạo liên phòng.
Ưu tiên hoàn toàn cho sự lựa chọn thứ nhất và đã được thử nghiệm với một quy trình đã được mô tả chi tiết.
Các nguyên tắc chung để ước lượng độ lệch chuẩn tái lập được đưa ra trong 4.4 và mỗi sự lựa chọn được mô tả chi tiết từ Điều 5 đến Điều 7.
4.3. Độ không đảm bảo mở rộng
Độ không đảm bảo mở rộng U (được định nghĩa bởi GUM) có được từ độ không đảm bảo đo chuẩn tổng hợp uc(y) với hệ số phủ k được chọn trong tiêu chuẩn này là 2 (tương đương với độ tin cậy xấp xỉ 95 %):
U = 2uc(y)
4.4. Nguyên tắc chung cho ước lượng độ lệch chuẩn tái lập
Thuật ngữ “hộp đen” được mô tả trong tiêu chuẩn này cần được tính đến tới mức có thể các nguồn không đảm bảo theo Hình 1. Cụ thể, phòng thử nghiệm cần am hiểu về sự phân bố các vi sinh vật bên trong các nền mẫu thử nghiệm để đưa vào ước lượng độ không đảm bảo của thành phần mẫu con (xem 3.1).
Độ lệch chuẩn tái lập sẽ được ước lượng cho mỗi loại vi sinh vật đích (hoặc nhóm các vi sinh vật đích thích hợp) và đối với mỗi nền mẫu (hoặc nhóm các nền mẫu tương tự) theo phương pháp phòng thử nghiệm sử dụng để đưa ra các kết quả thường ngày.
CHÚ THÍCH 1: Thuật ngữ “tương tự” có nghĩa là nhóm các vi sinh vật/các phương pháp hoặc nhóm các nền mẫu đưa ra các giá trị tương đương của MU.
CHÚ THÍCH 2: Ước lượng MU liên quan với phòng thử nghiệm và mối liên kết giữa kết quả thử và MU, được xác định với các điều kiện định rõ như người phân tích, quy trình thử nghiệm, thiết bị, thuốc thử... Ước lượng MU không thể hiện đặc trưng của phương pháp phân tích mà thể hiện đặc trưng cho phòng thử nghiệm thực hiện phương pháp phân tích.
Theo các nguyên tắc của TCVN ISO/IEC 17025, các yếu tố quyết định liên quan đến phương pháp hoặc phòng thử nghiệm có khả năng ảnh hưởng đến kết quả phép đo cần được xác định và chứng minh là đã được kiểm soát. Ví dụ về các yếu tố quyết định như vậy là nguồn gốc và phân loại như môi trường nuôi cấy và/hoặc các thuốc thử khác (như các thuốc thử dùng để khẳng định), các kỹ thuật đếm (thủ công hay tự động), người phân tích hoặc nhóm người phân tích... Việc tiếp tục giám sát ước lượng MU cần phải cho thấy nó vẫn thích đáng và các kết quả thử nghiệm đều được kiểm soát. Đánh giá lại ước lượng MU là cần thiết khi có sự thay đổi của bất kì yếu tố quyết định nào.
5. Độ lệch chuẩn tái lập trong phòng thử nghiệm
5.1. Yêu cầu chung
Độ lệch chuẩn tái lập trong phòng thử nghiệm là phần thường hay được lựa chọn để đưa ra độ không đảm bảo đo gắn với các kết quả báo cáo của phòng thử nghiệm, vì vậy, đó là nguyên tắc xác định độ không đảm bảo đo. Điều này phù hợp với trường hợp điển hình của độ chụm trung gian được đưa ra trong TCVN 6910-3 (ISO 5725-3). Mặt hạn chế về lí thuyết của sự lựa chọn này là không thể đưa độ chệch vào tính toán.
5.2. Quy trình thử nghiệm
5.2.1. Yêu cầu chung
Vi sinh vật trong thực phẩm, không thể loại trừ ảnh hưởng của nền mẫu tới độ không đảm bảo đo; do đó quy trình thử nghiệm phải tính đến ảnh hưởng của việc lấy phần mẫu thử từ mẫu phòng thử nghiệm (ví dụ: mẫu thực phẩm được kiểm tra).
Đối với mỗi vi sinh vật đích [hoặc nhóm vi sinh vật thích hợp 2)] và loại nền mẫu, quy trình thử nghiệm (5.2.2) cần tiến hành ít nhất 10 mẫu trên cùng một loại nền. Việc thực hiện quy trình nên lặp lại trong nhiều ngày khác nhau để bao trùm những biến đổi ở các điều kiện thử nghiệm theo thời gian. Quá trình này cũng tập hợp lại các dữ liệu ở từng thời điểm một.
Số loại nền mẫu thử nghiệm phụ thuộc vào tính đa dạng của nền mẫu do phòng thử nghiệm phân tích hàng ngày. Cần lựa chọn các nền mẫu đại diện cho các giá trị MU, với kiểu nền mẫu phòng thử nghiệm phân tích và có liên quan tới các vi sinh vật thử nghiệm. Phụ Iục A đưa ra hướng dẫn về sự lựa chọn này, qua việc cung cấp kết quả của các thử nghiệm được thực hiện ở nhiều quốc gia với mục đích đánh giá thành phần MU gắn với mẫu con của phần mẫu thử phòng thử nghiệm và chuẩn bị huyền phù ban đầu. Hướng dẫn thêm được đề cập trong Phụ lục B của ISO 16140:2003.
Việc tính toán độ lệch chuẩn bằng dữ liệu dạng log ổn định sự dao động độ tái lập ở nhiều mức độ nhiễm và các kết quả có số đếm thấp không được sử dụng trong tính toán (xem 5.3). Vì vậy không cần phải ước lượng độ lệch chuẩn tái lập cho từng mức độ nhiễm. Tuy nhiên, khi có thể, nên chọn các mẫu và/hoặc các dung dịch pha loãng sao cho bao phủ dãy nồng độ vẫn thử nghiệm hàng ngày.
Nên dùng mẫu bị nhiễm tự nhiên khi có thể, vì chúng làm cho ước tính độ không đảm bảo đo sát với các kết quả đặc trưng của những mẫu này hơn. Ngoài ra, trạng thái sinh lí của vi sinh vật (ví dụ: bị ức chế) có thể cũng ảnh hưởng đến độ biến thiên của các kết quả do vậy nên giống với các điều kiện được tính trong thử nghiệm hàng ngày.
Nếu cần gây nhiễm thì phải kiểm soát chặt chẽ sao cho không đưa thêm vào yếu tố làm biến thiên tới các kết quả. Việc gây nhiễm nên thiết kế sao cho giống với ô nhiễm thực tới mức có thể (ví dụ. bằng cách sử dụng các vi sinh vật bị ức chế và bao gồm cả vi sinh vật cạnh tranh/quần thể nền).
5.2.2. Mô tả
Quy trình được mô tả trong Hình 2.
Đối với mỗi mẫu thử, mỗi người phân tích lấy một phần để kiểm tra và chuẩn bị một dung dịch huyền phù ban đầu, thực hiện một lần phân tích. Tiến hành phân tích như thường lệ (ví dụ: chuẩn bị một dãy các độ pha loãng thập phân, cấy 1 hoặc 2 đĩa cho mỗi độ pha loãng).
CHÚ THÍCH 1: Trong thực tế, người phân tích có thể là một nhóm các nhân viên kỹ thuật, mỗi người thực hiện một phần của quy trình. Trong trường hợp đó, nhóm này được coi là một người phân tích và bất kì sự thay đổi về phân công nhiệm vụ của thành viên đều được coi như một người phân tích khác.
CHÚ THÍCH 2: Quy trình này theo phương pháp “hộp đen” được mô tả trong 3.1. Các nguồn khác nhau của độ không đảm bảo như mẫu con, bản chất của nền mẫu, sai số ngẫu nhiên thặng dư, người phân tích/thời gian… được coi là đồng thời nhưng không đánh giá riêng rẽ.
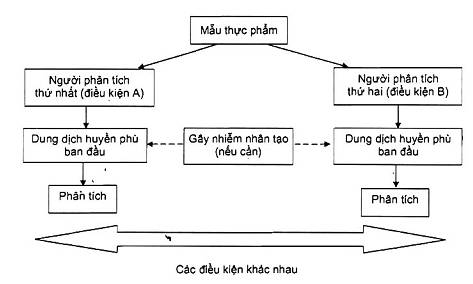
Hình 2 - Quy trình thử nghiệm để tính độ lệch chuẩn tái lập phòng thử nghiệm
Các điều kiện A và B nên khác hẳn nhau đến mức có thể chấp nhận được và lí tưởng là gồm nhiều sự thay đổi nhất từ ngày này qua ngày khác trong phòng thử nghiệm, như các kỹ thuật viên, các mẻ môi trường nuôi cấy và các thuốc thử, máy trộn mẫu, máy đo pH, các tủ ấm, thời gian phân tích... Nếu các mẫu thực phẩm bị nhiễm được chứng minh là ổn định (điều này là trường hợp hiếm trong vi sinh vật thực phẩm), các điều kiện A và B cũng nên gắn liền với các ngày phân tích khác nhau.
5.2.3. Sử dụng
Hình 3 chỉ ra các nguồn chính của độ không đảm bảo được bao hàm trong quy trình này cũng như các nguồn đã được loại trừ (lấy mẫu và độ chệch).
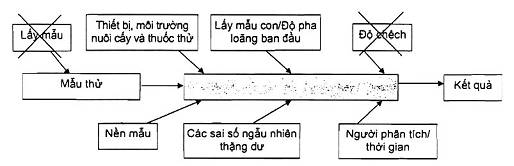
CHÚ THÍCH: Các nguồn loại trừ được đánh dấu gạch chéo.
Hình 3 - Các nguồn chính của độ không đảm bảo đo được bao phủ hoặc loại trừ trong thử nghiệm về độ tái lập nội bộ phòng thử nghiệm
Như đã giải thích trong 4.2.1, quy trình này kết hợp ảnh hưởng của việc lấy phần mẫu thử trong ước lượng độ không đảm bảo tổng. Ngoài ra, thực tế là vi sinh vật trong thực phẩm là do bị nhiễm tự nhiên vào các sản phẩm thực phẩm (đặc biệt là các sản phẩm rắn, sau quá trình chế biến, làm chín...) thường độ đồng nhất không cao. Việc tính đến độ biến thiên của các kết quả do sự không đồng nhất này là quan trọng khi đánh giá mức độ phù hợp của mẫu thử từ kết quả phân tích (như các chỉ tiêu vi sinh vật) so với giới hạn qui định.
CHÚ THÍCH: Nếu thực hiện gây nhiễm nhân tạo dung dịch huyền phù ban đầu (một khả năng trong quy trình ở Hình 2), thành phần của độ không đảm bảo đo do gây nhiễm không đồng nhất trên nền mẫu không được tính đến.
Tuy nhiên, trong một số trường hợp, tính khả thi của quy trình này có thể không cao. Việc phân bố trong tình huống bị nhiễm tự nhiên gắn chặt chẽ với loại nền mẫu đã giải thích vì sao quy trình thử nghiệm cần được lặp lại với mỗi loại nền mẫu (hoặc nhóm các nền mẫu thích hợp) thường được phân tích ở phòng thử nghiệm. Điều này có thể dẫn đến các thử nghiệm có phạm vi quá rộng khi phòng thử nghiệm phân tích rất nhiều loại nền mẫu.
Cuối cùng, như đã đề cập trong 3.2, khả năng góp phần của độ chệch vào độ không đảm bảo đo không được đề cập trong quy trình này.
5.3. Tính kết quả
Các thử nghiệm cần được thực hiện sao cho đảm bảo được rằng số lượng khuẩn lạc đủ lớn thích hợp để đưa vào tính kết quả. Nên loại bỏ kết quả đếm dưới 10 khuẩn lạc. Các kết quả đếm từ 10 đến 30 khuẩn lạc cũng chỉ được tính đến khi độ lệch chuẩn tái lập sR mong muốn lớn hơn 0,2 log10 (cfu/g) hoặc 0,2 log10 (cfu/ml).
CHÚ THÍCH 1: Giới hạn của 10 (hoặc 30) khuẩn lạc áp dụng cho tổng số khuẩn lạc đếm được trên tất cả các đĩa, SC.
CHÚ THÍCH 2: Giới hạn này chỉ liên quan đến các trường hợp cụ thể trong thực nghiệm về độ lệch chuẩn tái lập nội bộ phòng thử nghiệm (nghĩa là các thử nghiệm có mục đích đặc biệt để đánh giá độ không đảm bảo đo) và không sử dụng độ lệch chuẩn này để tính độ không đảm bảo đo đối với mẫu thử mới (xem Điều 8).
Thông thường, trước khi tính toán, dữ liệu (các kết quả đếm vi sinh vật) theo cfu/g hoăc cfu/ml sẽ được chuyển thành dạng log10(cfu/g) hoặc Iog10(cfu/ml).
CHÚ THÍCH 3: Theo TCVN 6398-11 (ISO 31-11), kí hiệu cho các loga thập phân là “lg”. Tuy nhiên, trong cấu trúc của tiêu chuẩn này, kí hiệu “log10” thường được dùng rộng rãi trong các phòng thử nghiệm vi sinh vật thực phẩm.
Tính toán độ lệch chuẩn tái lập sR đối với n mẫu của một nền mẫu được đưa ra như sau:
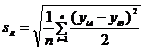
Trong đó:
yij là dữ liệu được chuyển thành dạng log, dưới dạng log10(cfu/g) hoặc log10(cfu/ml);
i là chỉ số mẫu, i = 1 đến n (n ³ 10);
j là chỉ số của điều kiện tái lập, j = A hoặc B.
Ví dụ định lượng vi sinh vật hiếu khí ưa ấm trong thịt gia cầm trộn được nêu trong Bảng 1.
Bảng 1 - Tính độ lệch chuẩn tái lập - Ví dụ về định lượng vi sinh vật hiếu khí trong thịt gia cầm trộn
|
i |
XiA |
XiB |
yiA = log10(XiA) |
yiB = log10(XiB) |
|
|
1 |
6,7 x 104 |
8,7 x 104 |
4,83 |
4,94 |
0,0064 |
|
2 |
7,1 x 106 |
6,2 x 106 |
6,85 |
6,79 |
0,0017 |
|
3 |
3,5 x 105 |
4,4 x 105 |
5,54 |
5,64 |
0,0049 |
|
4 |
1,0 x 107 |
4,3 x 106 |
7,00 |
6,63 |
0,0672 |
|
5 |
1,9 x 107 |
1,7 x 107 |
7,28 |
7,23 |
0,0012 |
|
6 |
2,3 x 105 |
1,5 x 105 |
5,36 |
5,18 |
0,0172 |
|
7 |
5,3 x 108 |
4,1 x 108 |
8,72 |
8,61 |
0,0062 |
|
8 |
1,0 x 104 |
1,2 x 104 |
4,00 |
4,08 |
0,0031 |
|
9 |
3,0 x 104 |
1,3 x 104 |
4,48 |
4,11 |
0,0659 |
|
10 |
1,1 x 108 |
2,2 x 108 |
8,04 |
8,34 |
0,0453 |
Sử dụng dữ liệu được chuyển dưới dạng log yif, độ lệch chuẩn tái lập là:
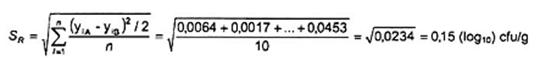
6. Độ lệch chuẩn tái lập của phương pháp thu được từ nghiên cứu liên phòng
6.1. Yêu cầu chung
Nếu phương pháp sử dụng thường xuyên tại phòng thử nghiệm được đưa vào nghiên cứu liên phòng để xác nhận giá trị sử dụng thì phòng thử nghiệm có thể sử dụng độ lệch chuẩn tái lập của phương pháp đó để ước lượng độ không đảm bảo đo trong các điều kiện nhất định (xem dưới đây). Điều kiện tiên quyết này được đánh giá bởi thực tế rằng độ lệch chuẩn nhận được từ nghiên cứu liên phòng gắn liền với phương pháp và không liên quan đến phòng thử nghiệm đưa ra báo cáo độ không đảm bảo đo của các kết quả của phòng thử nghiệm đó.
Các điều kiện này như sau:
- độ chệch phòng thử nghiệm phải tương ứng với dữ liệu kì vọng trên cơ sở của các ước lượng độ lặp lại và độ tái lập nhận được từ nghiên cứu liên phòng;
- độ chụm đạt được bởi các phép đo trong phòng thử nghiệm phải tương ứng với dữ liệu kì vọng từ những ước lượng độ lặp lại và độ tái lập nhận được từ nghiên cứu liên phòng;
- nghiên cứu liên phòng đã bao phủ hợp lí tất cả các nguồn của độ không đảm bảo đo (đặc biệt là việc chuẩn bị mẫu và đồng hóa mẫu).
Quy trình để kiểm tra các điều kiện này có phù hợp hay không và làm thế nào kết hợp ước lượng độ không đảm bảo đo tổng hợp thêm với các yếu tố không bao hàm trong nghiên cứu liên phòng, được mô tả chi tiết trong ISO/TS 21748.
6.2. Sử dụng cho vi sinh vật trong thực phẩm
Hình 4 chỉ ra các nguồn chính của độ không đảm bảo đo được đề cập trong quy trình này cũng như nguồn được loại trừ (lấy mẫu).
CHÚ THÍCH: Các nguồn loại trừ được đánh dấu gạch chéo.
Hình 4 - Các nguồn chính của độ không đảm bảo đo được bao gồm hoặc loại trừ bởi độ tái lập giữa các phòng thử nghiệm
Mở rộng ra, việc lấy mẫu con, chuẩn bị dung dịch pha loãng ban đầu cũng như ảnh hưởng của nền mẫu được đề cập phụ thuộc vào mô hình bố trí thử nghiệm.
Phương pháp này cho phép một phòng thử nghiệm đã tham gia nghiên cứu liên phòng đánh giá độ chệch phòng thử nghiệm của mình, độ chệch là một nguồn của MU. Đây là khía cạnh không được nêu chi tiết trong tiêu chuẩn này.
Tuy nhiên, đối với vi sinh vật trong thực phẩm, phương pháp này có một vài hạn chế được trình bày dưới đây. Điều này giải thích vì sao nó chỉ được cân nhắc như sự lựa chọn thứ 2.
Ngoài ra, cần kiểm soát độ chụm và độ chệch của phòng thử nghiệm phù hợp với các giá trị tương ứng của nghiên cứu liên phòng của phương pháp. Đây là điều cần thiết để ghi nhận rằng chỉ có một số giới hạn các thông số tái lập nhận được từ các nghiên cứu liên phòng để chuẩn hóa các phương pháp tham chiếu [ví dụ: ước lượng B. cereus trong TCVN 4992 (ISO 7932). C. perfringens trong TCVN 4991 (ISO 7937), Staphylococci dương tính coagulase trong TCVN 4830-1 (ISO 6888-1) và TCVN 4830-2 (ISO 6888-2) và L. monocytogenes trong TCVN 7700-2 (ISO 11290-2)].
Hơn nữa, khó có thể khái quát hóa nét đặc trưng trong phân tích mẫu hàng ngày của phòng thử nghiệm. Các giá trị độ chụm từ nghiên cứu liên phòng sẽ được thể hiện dưới giới hạn độ chụm được xác định khi tổng hợp với nền mẫu, chủng vi sinh vật, mức độ ô nhiễm... và cho quần thể vi sinh vật nền (nếu có mặt).
Cuối cùng là đưa ra yêu cầu về tính đồng nhất đối với những mẫu được sử dụng cho các nghiên cứu liên phòng thử nghiệm. Việc cần phải gửi đến các phòng thử nghiệm các mẫu được làm đồng nhất và ổn định nhằm làm giảm sự biến đổi tự nhiên trong mẫu bị gây nhiễm có thể thấy trong thử nghiệm và là nguyên nhân dẫn đến ước lượng dưới ngưỡng của độ không đảm bảo.
7. Độ lệch chuẩn tái lập từ thử nghiệm thành thạo nội bộ phòng thử nghiệm
Nếu phòng thử nghiệm đã tham gia thử nghiệm liên phòng, thì phòng thử nghiệm có thể sử dụng độ lệch chuẩn tái lập từ kết quả so sánh liên phòng để suy ra độ không đảm bảo đo, theo các điều kiện sau:
- trong quá trình thử nghiệm liên phòng, phòng thử nghiệm sử dụng các phương pháp vẫn phân tích thường ngày;
- các mẫu sử dụng trong chương trình so sánh liên phòng có thể so sánh được (loại nền mẫu và mức độ bị nhiễm) với các mẫu được phân tích hàng ngày;
- các phòng thử nghiệm tham gia không sử dụng các phương pháp khác nhau, hoặc có số lượng thích hợp các thành viên tham gia đã sử dụng phương pháp như nhau, để cho phép ước lượng chính xác độ lệch chuẩn tái lập.
Hình 4 chỉ ra các nguồn chính của độ không đảm bảo đo được thể hiện bởi quy trình này cũng như quy trình đã loại trừ việc lấy mẫu.
Mục tiêu của phương pháp này là giúp phòng thử nghiệm tham gia vào thử nghiệm liên phòng có thể đánh giá thành phần độ chệch tới độ không đảm bảo đo. Khía cạnh đó không được nêu chi tiết trong tiêu chuẩn này.
8. Tính toán độ không đảm bảo đo mở rộng
8.1. Giới thiệu
Giả định rằng số đơn vị hình thành khuẩn lạc trong các đĩa petri tuân theo phân bố Poisson. Sai số ngẫu nhiên được tính đến trong ước lượng độ không đảm bảo mở rộng được mô tả trong 8.2.
CHÚ THÍCH: Các tính toán được mô tả để ước lượng độ lệch chuẩn tái lập trong phòng thử nghiệm (xem 5.3) không đề cập đến sai số ngẫu nhiên theo phân bố Poisson, có nghĩa rằng chúng đã loại ra các kết quả định lượng dựa vào số đếm thấp các khuẩn lạc đếm được.
8.2. Tính toán
8.2.1. Trường hợp chung
Biểu thị kết quả thử nghiệm y = log10x, khi đó độ không đảm bảo đo mở rộng, U, với hệ số phủ là 2 (tương ứng với độ tin cậy xấp xỉ 95 %) được tính theo Công thức (1):

Trong đó:
sR là độ lệch chuẩn tái lập;
0,18861/SC là thành phần phương sai theo phân bố Poisson, trong đó SC là tổng số khuẩn lạc đếm được trên tất cả các đĩa.
CHÚ THÍCH: Từ số thu được theo tính chất lí
thuyết của phân bố Poisson (sự bằng nhau giữa mong muốn và phương sai trực tiếp
dẫn đến hệ số biến thiên ước tính theo Poisson, CV = 1/![]() )
và một phép tính gần đúng thành phần phương sai Poisson trên thang logarit xấp
xỉ bằng bình phương hệ số biến thiên, (CV)2, nếu dùng thang logarit
tự nhiên và (log10e)2 = 0,18861 x (CV)2
nếu dùng thang logarit thập phân.
)
và một phép tính gần đúng thành phần phương sai Poisson trên thang logarit xấp
xỉ bằng bình phương hệ số biến thiên, (CV)2, nếu dùng thang logarit
tự nhiên và (log10e)2 = 0,18861 x (CV)2
nếu dùng thang logarit thập phân.
Độ không đảm bảo đo theo Công thức (1) phụ thuộc vào cả độ lệch chuẩn tái lập được ước lượng từ thực nghiệm với các số đếm cao, sR, và tổng số đĩa đếm của mẫu được nghiên cứu, SC. Để đơn giản hóa, nên dùng Công thức (1) khi có thể.
8.2.2. Sự khác nhau giữa các số đếm thấp và số đếm cao (không bắt buộc)
Đối với các số đếm cao, số hạng thứ hai trong căn bậc hai, số hạng Poisson phụ thuộc vào SC, có thể được bỏ qua và Công thức (1) được giản lược như sau:
U = 2sR (2)
Giá trị giới hạn, Clim là:
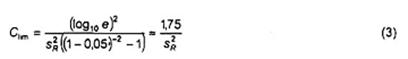
Đối với tất cả các trường hợp khi SC > Clim thì chênh lệch giữa U được tính bằng các Công thức (1) và (2) là không đáng kể (< 5 %).
Khi đã ước lượng được sR thì Clim có thể tính được bằng Công thức (3) hoặc được lấy ra từ Bảng B.1.
Có thể phân biệt hai trường hợp như sau:
Nếu SC > Clim thì sử dụng Công thức (2) để tính U;
Néu SC £ Clim thì sử dụng Công thức (1) để tính U.
CHÚ THÍCH Không cần tính Clim khi Công thức (1) được sử dụng trong tất cả các trường hợp.
9. Biểu thị độ không đảm bảo đo trong các báo cáo thử nghiệm
Độ không đảm bảo đã tính được như trong Điều 8 có thể được nêu rõ trong báo cáo, cùng với kết quả thử nghiệm, theo một khoảng trên thang logarit thập phân (xem Chú thích 5.3) hoặc theo các giá trị tự nhiên (cfu/g hoặc cfu/ml), hoặc theo một tỉ lệ phần trăm, được minh họa theo các cách sau.
Kết quả thử nghiệm có thể được báo cáo theo một trong các cách sau:
a) Khoảng cho kết quả log:
y ± U [log10 (cfu/g)] hoặc
y ± U [log10 (cfu/ml)];
b) Kết quả loga thập phân ước lượng với các giới hạn:
y [log10 (cfu/g)] [y - U, y + U] hoặc
y [log10 (cfu/ml)] [y - U, y + U];
c) Kết quả ước lượng với các giới hạn tuyệt đối:
x cfu/g [10y-U,10y+U] hoặc
x cfu/ml [10y-U,10y+U]
d) Kết quả ước lượng với các giới hạn tương đối:
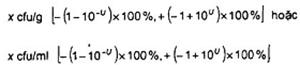
CHÚ THÍCH 1 Các giới hạn tương đối phụ thuộc chỉ vào U. Các ví dụ của các giới hạn tương đối được nêu trong Bảng B.1.
CHÚ THÍCH 2 Trong khi x có đơn vị là cfu/g hoặc cfu/ml thì y, theo logarit, không có thứ nguyên giống như pH. Để nhắc nhở người sử dụng về đơn vị của dữ liệu thô và loại logarit được sử dụng, Iog10(cfu/g) hoặc log10(cfu/ml) có thể được thêm vào trong dấu ngoặc đơn sau kết quả bằng số.
VÍ DỤ 1:
Độ lệch chuẩn tái lập, sR là 0,15 [log10(cfu/g)].
Kết quả thử nghiệm là 100 000 cfu/g, nghĩa Ià y = 5.00 [log10(cfu/g)], với SC = 110 (độ pha loãng -3: 102 khuẩn Iạc: độ pha loãng -4: 8 khuẩn lạc).
Do đó độ không đảm bảo đo mở rộng, U, với hệ số phủ bằng 2 (mức độ tin cậy xấp xỉ 95 %), theo Công thức (1), bằng:
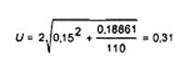
Kết quả thử nghiệm có thể được báo cáo theo một trong các cách sau:
5,0 ± 0,3 [log10(cfu/g)];
5,0 [log10(cfu/g)] [4,7; 5,3];
1,0 x 105 cfu/g [4,9 x 104; 2,0 x 105];
1,0 x 105 cfu/g [-51 %; +100 %].
CHÚ THÍCH: Chỉ áp dụng nếu dùng cả hai công thức (xem 8.2.2): Clim = 78. Sau đó, vì SC = 110 > Clim = 78 nên có thể sử dụng Công thức (2) giản lược đối với các số đếm cao U = 2 sR = 0,30.
VÍ DỤ 2:
Độ lệch chuẩn tái lập, sR là 0,25 [log10(cfu/g)].
Kết quả thử nghiệm là 280 cfu/g, nghĩa là y = 2,45 [log10(cfu/g)], với SC = 31 (độ pha loãng -1:1 ml trên 3 đĩa: 9 + 9 + 9 khuẩn lạc; độ pha loãng -2: 4 khuẩn lạc).
Do đó, độ không đảm bảo đo mở rộng, U, với hệ số phủ 2 (mức độ tin cậy xấp xỉ 95 %), theo Công thức (1), bằng:

Kết quả thử nghiệm có thể được báo cáo theo một trong các cách sau:
2,4 ± 0,5 [log10(cfu/g)]
2,4 [log10(cfu/g)][1,9: 3,0];
280 cfu/g [85: 930]
280 cfu/g [-70 %; +230 %].
CHÚ THÍCH: Chỉ áp dụng nếu dùng cả hai công thức (xem 8.2.2): Clim = 28. Sau đó, vì SC = 31 > Clim = 28 nên có thể sử dụng Công thức (2) giản lược đối với các số đếm cao U = 2 sR = 0,50.
VÍ DỤ 3:
Độ lệch chuẩn tái lập, sR là 0,11 [log10(cfu/g)].
Kết quả thử nghiệm là 100 cfu/g, nghĩa Ià y = 2,00[log10(cfu/g)], với SC = 11 (độ pha loãng -1: 9 khuẩn lạc; độ pha loãng -2: 2 khuẩn lạc).
Do đó độ không đảm bảo đo mở rộng, U, với hệ số phủ 2 (mức độ tin cậy xấp xỉ 95 %), theo Công thức (1), bằng:
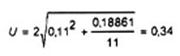
Kết quả thử nghiệm có thể được báo cáo theo một trong các cách sau:
2,0 ± 0,3 [log10(cfu/g)];
2,0 [log10(cfu/g)] [1,7: 2,3];
100 cfu/g [46; 220];
100 cfu/g [-54 %; +120 %].
CHÚ THÍCH: Chỉ áp dụng nếu dùng cả hai công thức (xem 8.2.2): Clim = 144. Sau đó, vì SC = 11 > Clim = 144 nên không thể sử dụng công thức (2) giản đối với các số đếm cao.
VÍ DỤ 4 (chỉ áp dụng nếu dùng cả hai công thức).
Độ lệch chuẩn tái lập, sR tìm được là 0,22 [log10(cfu/g)].
Clim = 36. Sau đó, nếu SC > Clim = 36, áp dụng công thức (2) giản lược cho các số đếm cao, U = 2 x 0,22 = 0,44.
Nguyên tắc chung, chỉ áp dụng cho các kết quả với SC > 36, có thể được biểu thị theo một trong các cách sau:
kết quả log ± 0,44 [log10(cfu/g)];
kết quả log [log10 (cfu/g)][kết quả log - 0,44; kết quả log + 0,44];
kết quả cfu/g [10kết quả log - 0,44; 10kết quả log + 0,44];
kết quả cfu/g [-0,64 %; +175 %]
Nếu SC £ 36, hoặc nếu một phương trình có thể áp dụng mọi lúc một cách đơn giản, thì sử dụng Công thức (1).
PHỤ LỤC A
(Tham khảo)
CÁC KẾT QUẢ CỦA CÁC THỬ NGHIỆM VỀ THÀNH PHẦN ĐỘ KHÔNG ĐẢM BẢO ĐO LIÊN QUAN ĐẾN MẪU CON CỦA PHẦN MẪU THỬ KIỂM TRA VÀ LIÊN QUAN ĐẾN SỰ CHUẨN BỊ DUNG DỊCH HUYỀN PHÙ BAN ĐẦU
A.1. Trình bày và quy trình thử nghiệm
Các thử nghiệm do AFSSA (PHÁP) thay mặt cho Tiểu ban kỹ thuật ISO/TC 34/SC 9, tổ chức năm 2003 và 2004. Mục tiêu là ước lượng ảnh hưởng của các nền mẫu sản phẩm khác nhau tới các thành phần của độ không đảm bảo đo (MU). MU liên quan đến việc lấy mẫu con từ phần mẫu thử (trong mẫu phân tích) và việc chuẩn bị dung dịch huyền phù ban đầu (xem Tài liệu tham khảo [18]).
Quy trình bao gồm tám phép ước lượng cho một mẫu, như được nêu trong Hình A.1.
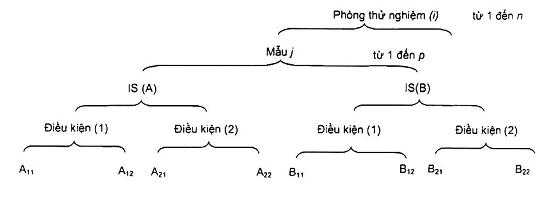
Hình A.1 - Quy trình thử nghiệm
Trong Hình A.1:
- IS (A) và IS (B) là chữ viết tắt của hai dung dịch huyền phù ban đầu được chuẩn bị độc lập và càng khác nhau càng tốt (ví dụ: những người phân tích khác nhau, cân khác nhau, mẻ dịch pha loãng khác nhau...);
- Điều kiện (1) và Điều kiện (2) là hai nhóm điều kiện càng khác nhau càng tốt (những người phân tích khác nhau, các mẻ môi trường khác nhau, các tủ ấm khác nhau...);
- các chỉ số A11 A12... biểu thị hai lần lặp lại trong các điều kiện lặp lại (nghĩa là hai dãy dung dịch pha loãng cho mỗi huyền phù ban đầu, cho mỗi tập hợp các điều kiện).
Chú ý rằng quy trình nêu trong Hình 2 (xem 5.2.2) được giản lược từ Hình A.1; trong Hình 2, chỉ có các số ước lượng được ghi A11 và B21 trong Hình A.1 được chỉ ra.
A.2. Kết quả
A.2.1. Yêu cầu chung
Tổng số 79 phòng thử nghiệm đã tham gia trong các chương trình thử nghiệm và mỗi phòng trong số đó thử nghiệm bằng một hoặc nhiều phương pháp, trên một hoặc nhiều nền mẫu, kết quả thu thập được 124 hồ sơ dữ liệu (1 phòng thử nghiệm x 1 phương pháp x 1 nền mẫu). Trong số này, 28 hồ sơ dữ liệu đã bị loại bởi vì phân tích không phù hợp với yêu cầu đặt ra cho các chương trình thử nghiệm.
Do đó, còn 96 độ lệch chuẩn tái lập (sR), mỗi số xác định một phòng thử nghiệm, một phương pháp và một nền mẫu. Ngoài ra, lý thuyết về các thành phần khác nhau cho phép xác định vai trò của ba nguồn không đảm bảo đối với mỗi độ lệch chuẩn tái lập là:
a) các nguồn gắn với nền mẫu, việc lấy mẫu con của phần mẫu thử và độ pha loãng ban đầu;
b) các nguồn gắn với các điều kiện tái lập (người phân tích/thời gian);
c) các sai số ngẫu nhiên trong các điều kiện lặp lại.
A.2.2. Phân loại các nền mẫu
Dựa vào các kết quả của các chương trình thử nghiệm này, nền mẫu được chia thành bốn loại theo các đặc tính vật lí:
- Loại i): dạng chất lỏng và các loại bột (ví dụ: sữa, sữa dừa, sữa bột...)
- Loại ii): dạng rắn đã được trộn đều (ví dụ: thịt xay, thịt được cắt nhỏ, thịt xúc xích, thịt xay nhuyễn, cream đã được đánh bông, kem lạnh thực phẩm, cream đậu nành...)
- Loại iii): dạng rắn nhỏ (hoặc rất nhỏ) (ví dụ: mùi tây khô/nấm khô, bột cà rốt/cần tây, salad, tôm, ngũ cốc, thức ăn chăn nuôi, hạt quả phỉ cắt nhỏ...);
- Loại iv): các dạng rắn khác (ví dụ: thịt nguyên miếng, phomat, bột nhão...)
Tính chất vật lí này ảnh hưởng lớn đến sR và độ lêch chuẩn của hai trong số các nguồn không đảm bảo; một nguồn liên quan đến nền mẫu (bao gồm việc lấy mẫu con của phần mẫu thử) và một nguồn liên quan đến sự chuẩn bị dung dịch pha loãng ban đầu. Những so sánh cặp đôi cho thấy sự khác nhau đáng kể giữa hai loại nền mẫu đầu tiên (dạng lỏng, dạng bột và dạng rắn trộn đều) và giữa hai loại cuối cùng (các chất rắn dạng nhỏ và chất rắn dạng khác).
Đối với hai loại đầu tiên, nền mẫu gây ra khoảng 0,1 log10 đơn vị (xem chú thích trong 5.3) của độ lệch chuẩn chung, không tính đến phòng thử nghiệm và quần thể vi sinh vật. Đối với hai loại cuối cùng, không thể đánh giá được thứ tự mức độ tác động riêng rẽ của quần thể vi sinh vật và phòng thử nghiệm. Chú ý rằng hầu hết các sản phẩm trong hai loại cuối cùng có thể được trộn bằng cách sử dụng bộ trộn rồi có thể được coi như loại nền mẫu thứ hai.
A.2.3. Kết quả chi tiết
Các kết quả chi tiết thu được từ 96 hồ sơ dữ liệu có thể sử dụng được nêu trong các bảng từ Bảng A.1 đến Bảng A.5, cho mỗi quần thể vi sinh vật đích.
Trong mỗi bảng:
- việc phân loại được xác định như trong A.2.2;
- siS là thành phần của độ lệch chuẩn do dung dịch huyền phù ban đầu (bao gồm các ảnh hưởng của nền mẫu, việc lấy mẫu con và việc chuẩn bị dung dịch huyền phù ban đầu);
- sR là độ lệch chuẩn tái lập;
- scond là “thành phần” do các điều kiện (bao gồm các ảnh hưởng của thời gian/người phân tích);
- sres là độ lệch chuẩn thặng dư (gồm các ảnh hưởng của sai số ngẫu nhiên).
Tất cả các độ lệch chuẩn được biểu thị dưới dạng log10 (cfu/g) hoặc log10 (cfu/ml).
A.3. Sử dụng
Trong khuôn khổ của tiêu chuẩn này, kết quả của các thử nghiệm, nghĩa là 4 loại chính được giải thích trong A.2.2 và các kết quả chi tiết trong A.2.3 có thể được coi như hướng dẫn cho các phòng thử nghiệm khi chọn các nền mẫu thử nghiệm để ước lượng độ không đảm bảo đo (xem 5.2.1).
Bảng A.1 - Độ lệch chuẩn đối với hệ vi sinh vật hiếu khí
|
Mã phòng thử nghiệm |
Thực phẩm |
Hạng |
sIS |
sR |
sros |
scond |
|
2 |
Cá |
iv |
0,36 |
0,43 |
0,23 |
0,06 |
|
2 |
Thịt bê xay đông lạnh |
ii |
0,07 |
0,25 |
0,24 |
0,06 |
|
3 |
Bánh ngọt |
iv |
0,12 |
0,18 |
0,11 |
0,07 |
|
4 |
Cá |
iv |
0,37 |
0,51 |
0,29 |
0,20 |
|
7 |
Thực phẩm ăn ngay |
iv |
0,24 |
0,33 |
0,17 |
0,13 |
|
8 |
Thịt bò xay đóng gói chân không |
ii |
0,09 |
0,15 |
0,10 |
0,06 |
|
10 |
Salad tươi đóng gói |
iii |
0,10 |
0,45 |
0,17 |
0,41 |
|
10 |
Bột hành khô |
ii |
0,17 |
0,24 |
0,13 |
0,11 |
|
11 |
Pa tê |
iv |
0,72 |
0,78 |
0,10 |
0,29 |
|
11 |
Bánh ngọt |
iv |
0,05 |
0,19 |
0,12 |
0,13 |
|
11 |
Nấm khô |
iii |
0,14 |
0,26 |
0,15 |
0,16 |
|
12 |
Da cổ gà |
iv |
0,19 |
0,20 |
0,06 |
0,02 |
|
13 |
Ốc chín |
iv |
0,06 |
0,13 |
0,10 |
0,05 |
|
14 |
Bánh ngọt |
iv |
0,32 |
0,35 |
0,11 |
0,08 |
|
20 |
Da cổ gà |
iv |
0,14 |
0,16 |
0,05 |
0,06 |
|
20 |
Thịt gà tây cắt bằng máy |
ii |
0,10 |
0,13 |
0,06 |
0,05 |
|
20 |
Thịt gà cắt bằng máy |
ii |
0,10 |
0,14 |
0,09 |
0,05 |
|
25 |
Pa tê |
iv |
0,46 |
0,47 |
0,07 |
0,03 |
|
26 |
Phomat từ sữa tươi |
iv |
0,16 |
0,26 |
0,09 |
0,19 |
|
27 |
Dăm bông cắt lát |
iv |
0,30 |
0,31 |
0,06 |
0,05 |
|
30 |
Bánh ngọt |
iv |
0,09 |
0,12 |
0,06 |
0,05 |
|
31 |
Cà rốt nạo |
iii |
0,09 |
0,14 |
0,08 |
0,08 |
|
32 |
Xúc xích lợn tươi |
iv |
0,20 |
0,24 |
0,12 |
0,05 |
|
34 |
Thịt lợn tươi |
iv |
0,70 |
0,70 |
0,06 |
0,05 |
|
38 |
Kem vani |
ii |
0,03 |
0,10 |
0,09 |
0,02 |
|
41 |
Sữa bột (môi trường) |
i |
0,05 |
0,14 |
0,10 |
0,08 |
|
42 |
Sữa bột |
i |
0,02 |
0,05 |
0,04 |
0,02 |
|
43 |
Tôm đông lạnh |
iii |
0,19 |
0,20 |
0,05 |
0,05 |
|
44 |
Tôm đông lạnh |
iii |
0,09 |
0,18 |
0,14 |
0,08 |
|
48 |
Sữa |
i |
0,04 |
0,12 |
0,06 |
0,09 |
|
49 |
Tinh bột ngô |
i |
0,09 |
0,14 |
0,06 |
0,08 |
|
55 |
Salad tươi đóng gói |
iii |
0,15 |
0,20 |
0,06 |
0,11 |
|
72 |
Caseinat |
i |
0,03 |
0,09 |
0,08 |
0,04 |
|
76 |
Nước |
i |
0,04 |
0,10 |
0,09 |
0,03 |
|
77 |
Thịt bò xay |
ii |
0,07 |
0,09 |
0,05 |
0,03 |
|
79 |
Thịt gia cầm trộn |
ii |
0,03 |
0,13 |
0,09 |
0,07 |
|
Với phương pháp đường xoắn: |
||||||
|
1 |
Phomat từ sữa tươi |
iv |
0,29 |
0,38 |
0,12 |
0,21 |
|
24 |
Thức ăn khô cho chó |
iii |
0,18 |
0,24 |
0,13 |
0,09 |
|
59 |
Thịt xay |
ii |
0,17 |
0,23 |
0,15 |
0,05 |
Bảng A.2 - Độ lệch chuẩn đối với coliform
|
Mã phòng thử nghiệm |
Thực phẩm |
Hạng |
sIS |
sR |
sros |
scond |
|
1 |
Thịt bò xay đóng gói chân không |
iv |
0,32 |
0,35 |
0,11 |
0,07 |
|
3 |
Bánh ngọt |
iv |
0,16 |
0,23 |
0,15 |
0,07 |
|
6 |
Thịt bò tươi |
iv |
0,33 |
0,35 |
0,05 |
0,09 |
|
10 |
Salad tươi đóng gói |
iii |
0,41 |
0,78 |
0,33 |
0,58 |
|
12 |
Da cổ gà |
iv |
0,15 |
0,20 |
0,12 |
0,06 |
|
20 |
Da cổ gà |
iv |
0,07 |
0,12 |
0,09 |
0,05 |
|
26 |
Phomat từ sữa tươi |
iv |
0,30 |
0,33 |
0,09 |
0,10 |
|
29 |
Thịt gà thái bằng máy |
ii |
0,10 |
0,15 |
0,07 |
0,08 |
|
30 |
Bánh ngọt |
iv |
0,15 |
0,19 |
0,09 |
0,07 |
|
32 |
Xúc xích lợn tươi |
iv |
0,15 |
0,31 |
0,21 |
0,13 |
|
44 |
Phomat từ sữa tươi |
iv |
0,11 |
0,21 |
0,10 |
0,14 |
|
45 |
Thịt lợn tươi |
iv |
0,17 |
0,22 |
0,10 |
0,09 |
|
58 |
Sữa dừa đông lạnh |
i |
0,12 |
0,18 |
0,11 |
0,08 |
|
74 |
Cream đã đánh bông |
ii |
0,07 |
0,20 |
0,13 |
0,13 |
Bảng A.3 - Độ lệch chuẩn đối với E. coli
|
Mã phòng thử nghiệm |
Thực phẩm |
Hạng |
sIS |
sR |
sros |
scond |
|
9 |
Phomat từ sữa tươi |
iv |
0,45 |
0,47 |
0,10 |
0,06 |
|
16 |
Phomat từ sữa tươi |
iv |
0,09 |
0,13 |
0,07 |
0,07 |
|
17 |
Thịt gia cầm (không có da) |
iv |
0,27 |
0,35 |
0,10 |
0,20 |
|
18 |
Phomat từ sữa tươi |
iv |
0,25 |
0,27 |
0,07 |
0,06 |
|
19 |
Gan gia cầm |
iv |
0,12 |
0,16 |
0,09 |
0,05 |
|
35 |
Phomat từ sữa tươi |
iv |
0,13 |
0,18 |
0,12 |
0,03 |
|
37 |
Thịt bò xay đông lạnh |
ii |
0,13 |
0,17 |
0,10 |
0,05 |
|
47 |
Cream đậu tương |
ii |
0,13 |
0,44 |
0,15 |
0,39 |
|
50 |
Phomat từ sữa tươi |
iv |
0,29 |
0,30 |
0,04 |
0,02 |
|
50 |
Phomat từ sữa tươi |
iv |
0,24 |
0,26 |
0,08 |
0,05 |
|
51 |
Phomat từ sữa tươi |
iv |
0,13 |
0,15 |
0,07 |
0,02 |
|
52 |
Thịt xúc xích |
ii |
0,08 |
0,11 |
0,07 |
0,03 |
|
59 |
Thịt xay |
ii |
0,15 |
0,19 |
0,08 |
0,09 |
|
Số đếm có xác xuất lớn nhất |
||||||
|
78 |
Trai (hai mảnh vỏ) |
iii |
0,15 |
0,31 |
0,15 |
0,11 |
Bảng A.4 - Độ lệch chuẩn đối với Staphylococci dương tính coagulase
|
Mã phòng thử nghiệm |
Thực phẩm |
Hạng |
sIS |
sR |
sros |
scond |
|
1 |
Phomat từ sữa tươi |
iv |
0,26 |
0,33 |
0,16 |
0,14 |
|
16 |
Phomat từ sữa tươi |
iv |
0,08 |
0,16 |
0,11 |
0,09 |
|
28 |
Phomat từ sữa tươi |
iv |
0,15 |
0,24 |
0,17 |
0,08 |
|
46 |
Mì khô |
iii |
0,09 |
0,13 |
0,08 |
0,05 |
|
50 |
Phomat từ sữa tươi |
iv |
0,15 |
0,16 |
0,05 |
0,01 |
|
50 |
Phomat từ sữa tươi |
iv |
0,12 |
0,14 |
0,05 |
0,04 |
|
9 |
Phomat từ sữa tươi |
iv |
0,43 |
0,45 |
0,10 |
0,05 |
|
36 |
Phomat từ sữa tươi |
iv |
0,21 |
0,22 |
0,06 |
0,04 |
|
71 |
Phomat từ sữa tươi |
iv |
0,20 |
0,23 |
0,09 |
0,04 |
|
73 |
Phomat từ sữa tươi |
iv |
0,32 |
0,48 |
0,28 |
0,03 |
Bảng A.5 - Độ lệch chuẩn đối với các hệ vi sinh vật khác
|
Mã phòng thử nghiệm |
Thực phẩm |
Vi sinh vật |
Hạng |
sIS |
sR |
sros |
scond |
|
10 |
Bột hành khô |
nấm men + nấm mốc |
ii |
0,08 |
0,23 |
0,09 |
0,20 |
|
11 |
Nấm khô |
Bacillus cereus |
iii |
0,21 |
0,26 |
0,12 |
0,09 |
|
15 |
Thịt gia cầm (không có da) |
Pseudomonas |
iv |
0,20 |
0,34 |
0,14 |
0,24 |
|
20 |
Thịt gà tây thái bằng máy |
vi khuẩn khử sulfit |
ii |
0,05 |
0,10 |
0,08 |
0,03 |
|
20 |
Thịt gà thái bằng máy |
vi khuẩn khử sulfit |
ii |
0,09 |
0,14 |
0,09 |
0,06 |
|
21 |
Phomat từ sữa tươi |
L. monocytogenes |
iv |
0,59 |
0,60 |
0,10 |
0,05 |
|
22 |
Bột thức ăn gia súc |
Enterobacteriaceae |
iii |
0,31 |
0,33 |
0,11 |
0,05 |
|
33 |
Cần tây nghiền |
hệ vi khuẩn lactic |
iii |
0,08 |
0,25 |
0,14 |
0,20 |
|
39 |
Sữa bột |
Bifidobacterium |
i |
0,09 |
0,14 |
0,08 |
0,08 |
|
40 |
Mùi tây khô |
Bacillus cereus |
iii |
0,17 |
0,27 |
0,18 |
0,12 |
|
45 |
Thịt tươi |
Salmonella |
iv |
0,21 |
0,24 |
0,09 |
0,07 |
|
53 |
Thịt gà tây xay |
vi khuẩn khử sulfit |
ii |
0,07 |
0,25 |
0,12 |
0,21 |
|
54 |
Vả khô |
nấm men + nấm mốc |
iv |
0,74 |
0,75 |
0,07 |
0,01 |
|
55 |
Bỏng ngô |
nấm mốc |
iii |
0,32 |
0,36 |
0,11 |
0,12 |
|
56 |
Thịt gà tươi |
Enterobacteriaceae |
iv |
0,35 |
0,52 |
0,29 |
0,27 |
|
57 |
Thịt bò xay |
Enterobacteriaceae |
ii |
0,01 |
0,04 |
0,03 |
0,02 |
|
70 |
Quả phỉ |
nấm men + nấm mốc |
iii |
0,28 |
0,29 |
0,03 |
0,07 |
|
76 |
Nước |
Streptococcus |
i |
0,08 |
0,17 |
0,14 |
0,03 |
|
76 |
Nước |
Enterococcus |
i |
0,12 |
0,16 |
0,09 |
0,02 |
PHỤ LỤC B
(Tham khảo)
CÁC GIÁ TRỊ CỦA Clim VÀ CÁC GIỚI HẠN LIÊN QUAN
Khi đã biết sR thì giá trị Clim thu được bằng cách sử dụng Công thức (3). Các giá trị của Clim cũng được đưa ra trong Bảng B.1 với một số giá trị của sR. Ngoài ra, khi đã biết U [bằng cách sử dụng Công thức (1) hoặc Công thức (2)] thì các giới hạn liên quan [- (1 - 10-U) x 100%,+(-1 + 10U) x 100%] có thể giúp biểu thị các kết quả (xem Điều 9). Các giới hạn liên quan này cũng được đưa ra trong Bảng B.1 cho một số giá trị của U.
Bảng B.1 - Các glá trị của Clim và các giới hạn liên quan
|
Độ lệch chuẩn tái lập |
|
Độ không đảm bảo đo |
Các giới hạn liên quanb |
Độ lệch chuẩn tái lập |
|
Độ không đảm bảo đo |
Các giới hạn liên quanb |
||
|
sR |
Clima |
U |
dưới |
trên |
sR |
Clima |
U |
dưới |
trên |
|
0,01 |
17459 |
0,02 |
-5 |
5 |
0,51 |
7 |
1,02 |
-90 |
+947 |
|
0,02 |
4365 |
0,04 |
-9 |
10 |
0,52 |
6 |
1,04 |
-91 |
+996 |
|
0,03 |
1940 |
0,06 |
-13 |
15 |
0,53 |
6 |
1,06 |
-91 |
+1048 |
|
0,04 |
1091 |
0,08 |
-17 |
20 |
0,54 |
6 |
1,08 |
-92 |
+1102 |
|
0,05 |
698 |
0,10 |
-21 |
26 |
0,55 |
6 |
1,10 |
-92 |
+1159 |
|
0,06 |
485 |
0,12 |
-24 |
32 |
0,56 |
6 |
1,12 |
-92 |
+1218 |
|
0,07 |
356 |
0,14 |
-28 |
38 |
0,57 |
5 |
1,14 |
-93 |
+1280 |
|
0,08 |
273 |
0,16 |
-31 |
45 |
0,58 |
5 |
1,16 |
-93 |
+1345 |
|
0,09 |
216 |
0,18 |
-34 |
51 |
0,59 |
5 |
1,18 |
-93 |
+1414 |
|
0,10 |
175 |
0,20 |
-37 |
58 |
0,60 |
5 |
1,20 |
-94 |
+1485 |
|
0,11 |
144 |
0,22 |
-40 |
66 |
0,61 |
5 |
1,22 |
-94 |
+1560 |
|
0,12 |
121 |
0,24 |
-42 |
74 |
0,62 |
5 |
1,24 |
-94 |
+1638 |
|
0,13 |
103 |
0,26 |
-45 |
82 |
0,63 |
4 |
1,26 |
-95 |
+1720 |
|
0,14 |
89 |
0,28 |
-48 |
91 |
0,64 |
4 |
1,28 |
-95 |
+1805 |
|
0,15 |
78 |
0,30 |
-50 |
100 |
0,65 |
4 |
1,30 |
-95 |
+1895 |
|
0,16 |
68 |
0,32 |
-52 |
109 |
0,66 |
4 |
1,32 |
-95 |
+1989 |
|
0,17 |
60 |
0,34 |
-54 |
119 |
0,67 |
4 |
1,34 |
-95 |
+2088 |
|
0,18 |
54 |
0,36 |
-56 |
129 |
0,68 |
4 |
1,36 |
-96 |
+2191 |
|
0,19 |
48 |
0,38 |
-58 |
140 |
0,69 |
4 |
1,38 |
-96 |
+2299 |
|
0,20 |
44 |
0,40 |
-60 |
151 |
0,70 |
4 |
1,40 |
-96 |
+2412 |
|
0,21 |
40 |
0,42 |
-62 |
163 |
0,71 |
3 |
1,42 |
-96 |
+2530 |
|
0,22 |
36 |
0,44 |
-64 |
175 |
0,72 |
3 |
1,44 |
-96 |
+2654 |
|
0,23 |
33 |
0,46 |
-65 |
188 |
0,73 |
3 |
1,46 |
-97 |
+2784 |
|
0,24 |
30 |
0,48 |
-67 |
202 |
0,74 |
3 |
1,48 |
-97 |
+2920 |
|
0,25 |
28 |
0,50 |
-68 |
216 |
0,75 |
3 |
1,50 |
-97 |
+3062 |
|
0,26 |
26 |
0,52 |
-70 |
231 |
0,76 |
3 |
1,52 |
-97 |
+3211 |
|
0,27 |
24 |
0,54 |
-71 |
247 |
0,77 |
3 |
1,54 |
-97 |
+3367 |
|
0,28 |
22 |
0,56 |
-72 |
263 |
0,78 |
3 |
1,56 |
-97 |
+3531 |
|
0,29 |
21 |
0,58 |
-74 |
280 |
0,79 |
3 |
1,58 |
-97 |
+3702 |
|
0,30 |
19 |
0,60 |
-75 |
298 |
0,80 |
3 |
1,60 |
-97 |
+3881 |
|
0,31 |
18 |
0,62 |
-76 |
317 |
0,81 |
3 |
1,62 |
-98 |
+4069 |
|
0,32 |
17 |
0,64 |
-77 |
337 |
0,82 |
3 |
1,64 |
-98 |
+4265 |
|
0,33 |
16 |
0,66 |
-78 |
357 |
0,83 |
2 |
1,66 |
-98 |
+4471 |
|
0,34 |
15 |
0,68 |
-79 |
379 |
0,84 |
2 |
1,68 |
-98 |
+4656 |
|
0,35 |
14 |
0,70 |
-80 |
401 |
0,85 |
2 |
1,70 |
-98 |
+4912 |
|
0,36 |
13 |
0,72 |
-81 |
425 |
0,86 |
2 |
1,72 |
-98 |
+5148 |
|
0,37 |
13 |
0,74 |
-82 |
450 |
0,87 |
2 |
1,74 |
-98 |
+5395 |
|
0,38 |
12 |
0,76 |
-83 |
475 |
0,88 |
2 |
1,76 |
-98 |
+5654 |
|
0,39 |
11 |
0,78 |
-83 |
503 |
0,89 |
2 |
1,78 |
-98 |
+5926 |
|
0,40 |
11 |
0,80 |
-84 |
531 |
0,90 |
2 |
1,80 |
-98 |
+6210 |
|
0,41 |
10 |
0,82 |
-85 |
561 |
0,91 |
2 |
1,82 |
-98 |
+6510 |
|
0,42 |
10 |
0,84 |
-86 |
592 |
0,92 |
2 |
1,84 |
-98,6 |
+6818 |
|
0,43 |
9 |
0,86 |
-86 |
624 |
0,93 |
2 |
1,86 |
-98,6 |
+7144 |
|
0,44 |
9 |
0,88 |
-87 |
659 |
0,94 |
2 |
1,88 |
-98,7 |
+7486 |
|
0,45 |
9 |
0,90 |
-87 |
694 |
0,95 |
2 |
1,90 |
-98,7 |
+7843 |
|
0,46 |
8 |
0,92 |
-88 |
732 |
0,96 |
2 |
1,92 |
-98,8 |
+8218 |
|
0,47 |
8 |
0,94 |
-89 |
771 |
0,97 |
2 |
1,94 |
-98,9 |
+8610 |
|
0,48 |
8 |
0,96 |
-89 |
812 |
0,98 |
2 |
1,96 |
-98,9 |
+9020 |
|
0,49 |
7 |
0,98 |
-90 |
855 |
0,99 |
2 |
1,98 |
-99,0 |
+9450 |
|
0,50 |
7 |
1,00 |
-90 |
900 |
1,00 |
2 |
2,00 |
-99,0 |
+9900 |
|
a Clim, là giới hạn cho SC cao hơn thì có thể giản lược là U = 2sR. b Các giới hạn trên và dưới liên quan của khoảng độ không đảm bảo đo như phần trăm của kết quả dưới dạng cfu/g hoặc cfu/ml đối với độ không đảm bảo đo U (cột đầu tiên từ trái sang). |
|||||||||
THƯ MỤC TÀI LIỆU THAM KHẢO
[1] TCVN 6398-11 (ISO 31-11)3), Đại lượng và đơn vị - Phần 11: Dấu và kí hiệu toán học dùng trong khoa học vật lí và công nghệ
[2] TCVN 8244-1:2010 (ISO 3534-1:2006) Thống kê học - Từ vựng và ký hiệu - Phần 1: Thuật ngữ chung về thống kê và thuật ngữ dùng trong xác suất
[3] TCVN 6910-2 (ISO 5725-2), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 2: Phương pháp cơ bản xác định độ lặp lại và độ tái lập của phương pháp đo tiêu chuẩn
[4] TCVN 6910-3 (ISO 5725-3), Độ chính xác (độ đúng và độ chụm) của phương pháp đo và kết quả đo - Phần 3: Các thước đo trung gian độ chụm của phương pháp đo tiêu chuẩn
[5] TCVN 6507-1 (ISO 6887-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Chuẩn bị mẫu thử, huyền phù ban đầu và các dung dịch pha loãng thập phân để kiểm tra vi sinh vật - Phần 1: Các nguyên tắc chung để chuẩn bị huyền phù ban đầu và các dung dịch pha loãng thập phân
[6] TCVN 4830-1 (ISO 6888-1), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Staphylococci có phản ứng dương tính coagulase (Staphylococcus aureus và các loài khác) trên đĩa thạch - Phần 1: Kỹ thuật sử dụng môi trường thạch Baird-Parker
[7] TCVN 4830-2 (ISO 6888-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Staphylococci có phản ứng dương tính coagulase (Staphylococcus aureus và các loài khác) trên đĩa thạch - Phần 2: Kỹ thuật sử dụng môi trường thạch fibrinogen huyết tương thỏ
[8] TCVN 6404 (ISO 7218), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Yêu cầu chung và hướng dẫn kiểm tra vi sinh vật
[9] TCVN 4992 (ISO 7932), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Bacillus cereus giả định trên đĩa thạch - Kỹ thuật đếm khuẩn lạc ở 30 độ C
[10] TCVN 4991 (ISO 7937), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp định lượng Clostridium perfringens trên đĩa thạch - Kỹ thuật đếm khuẩn lạc
[11] TCVN 7700-2 (ISO 11290-2), Vi sinh vật trong thực phẩm và thức ăn chăn nuôi - Phương pháp phát hiện và định lượng Listeria monocytogenes - Phần 2: Phương pháp định lượng
[12] ISO 16140:2003, Microbiology of food animal feeding stuffs - Protocol for the validation of alternative method
[13] ISO/TS 21748, Guidance for the use of repeatability, reproducibility and trueness estimates in measurement uncertainty estimation
[14] TCVN ISO/IEC 17025, Yêu cầu chung về năng lực của phòng thử nghiệm và hiệu chuẩn
[15] GUM:1993, Guide to the expression of uncertainty in measurement BIPM/IEC/IFCC/ISO/IUPAC/IUPAP/OLML
[16] EURACHEM/CITAC Guide quantifying uncertainty in Analitical Mesurement, 2nd edition, QUAM: 2000, available at http://www.eurachem.ul.pt/guides/quam.htm or http://www.mesurementuncertainty.org.
[17] NIEMEIA, SI, Uncertainty of quantitative determinations derived by cultivation of microorganisms. MIKES J4, 2003; http://www.mikes.fi
[18] AH SOON, C. and CORNU, M. Report of 2003/2004 ISO Trials about uncertainty measurement, June 2004, AFSSA, Maisons-Alfort, France
1) Dưới 10 khuẩn lạc đếm được trong ít nhất một đĩa, thường tương ứng với ít hơn 100 cfu/g (cfu/ml) hoặc 1000 cfu/g (cfu/ml) sản phẩm phụ thuộc vào thể tích nuôi cấy (1 ml hoặc 0,1 ml).
2) Xem Chú thích 1, 4.4
3) TCVN 639811 (ISO 31-11) đã được hủy bỏ. Hiện nay có TCVN 7870-2 (ISO 80000-2) Đại lượng và đơn vị - Phần 2: Dấu và kí hiệu toán học dùng trong khoa học tự nhiên và công nghệ.










